Điện phân 800 ml dung dịch gồm NaCl, HCl và CuCl2 0,02M (điện cực trơ, màng
Câu hỏi :
Điện phân 800 ml dung dịch gồm NaCl, HCl và 0,02M (điện cực trơ, màng ngăn xốp) với cường độ dòng điện 9,65 A. Mối liên hệ giữa thời gian điện phân và pH của dung dịch điện phân được biểu diễn bằng đồ thị dưới đây (giả sử muối đồng không bị thủy phân).
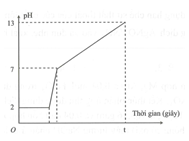
Giá trị của t trên đồ thị là
Điện phân 800 ml dung dịch gồm NaCl, HCl và 0,02M (điện cực trơ, màng ngăn xốp) với cường độ dòng điện 9,65 A. Mối liên hệ giữa thời gian điện phân và pH của dung dịch điện phân được biểu diễn bằng đồ thị dưới đây (giả sử muối đồng không bị thủy phân).

Giá trị của t trên đồ thị là
A. 2000
B. 3600
C. 1200
D. 3800
* Đáp án
C
* Hướng dẫn giải
Đáp án C.
Giai đoạn 1: pH = 2 và không đổi nên H+ chura điện phân và H2O ở cả 2 cực cũng chưa điện phân.
Giai đoạn 2: pH tăng đến 7 nên H+ dần điện phân hết, H2O ở cả 2 cực cũng chưa điện phân.
Giai đoạn 3: pH tăng đến 13 chứng tỏ H2O ở catot đã bắt đầu điện phân.
Lúc pH tăng đến 13 thì đồ thị dừng, chứng tỏ dung dịch sau chỉ chứa NaOH:
Lưu ý nhầm lẫn sau: Tính được thì nói chỉ điện phân ở catot là sai. Vì ở anot có thể bị điện phân thành và lượng đã bị trung hòa bởi .
Với cách nghĩ này dễ dẫn đến sai lầm tính
Câu hỏi trên thuộc đề trắc nghiệm dưới đây !
25 đề thi minh họa THPT Quốc gia môn Hóa học năm 2022 có đáp án !!
Copyright © 2021 HOCTAP247
