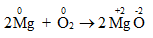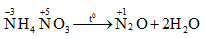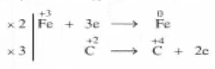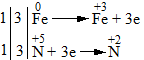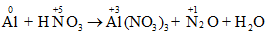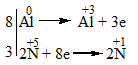Hoá học 10 Bài 17: Phản ứng oxi hóa khử
Tóm tắt bài
1.1. Định nghĩa
1.1.1. Thí dụ 1: Phản ứng đốt cháy Magie với Oxi
- Phương trình hóa học:
- Nhận xét:
-
Mg có số oxi hóa là 0, O có số oxi hóa là 0.
-
Sau phản ứng: Mg có số oxi hóa là + 2, O có số oxi hóa là -2.
-
Trong phản ứng này Mg nhường electron. Quá trình nhường electron của Mg là: \(\mathop {{\rm{Mg}}}\limits^{\rm{0}} \to \mathop {{\rm{Mg}}}\limits^{{\rm{ + 2}}} {\rm{ + 2e}}\)
-
-
Kết luận:
-
Quá trình Mg nhường electron gọi là quá trình oxi hóa Mg (sự oxi hóa Mg).
-
Mg đóng vai trò là chất khử.
-
Oxi đóng vai trò là chất oxi hóa.
-
1.1.2. Thí dụ 2: Phản ứng giữa CuO và khí H2
-
Phương trình hóa học: CuO + H2 → Cu + H2O
-
Nhận xét:
-
Trước phản ứng: Cu có số oxi hóa là + 2 , O có số oxi hóa là – 2 và H có số oxi hóa là 0.
-
Sau phản ứng: Cu có số oxi hóa là 0, O có số oxi hóa là -2 và H có số oxi hóa là + 1.
-
Trong phản ứng này Cu nhận electron. Quá trình nhận electron của Cu2+ là: \(\mathop {{\rm{Cu}}}\limits^{{\rm{ + 2}}} {\rm{ + 2e }} \to \mathop {{\rm{ Cu}}}\limits^{\rm{0}}\)
-
- Kết luận:
- Quá trình Cu2+ nhận electron gọi là quá trình khử Cu2+ (Sự khử Cu2+)
- CuO đóng vai trò là chất oxi hóa.
- H2 đóng vai trò là chất khử.
1.1.3. Tổng kết
- Chất khử (chất bị oxi hóa) là chất nhường electron.
- Chất oxi hóa (chất bị khử) là chất thu electron.
- Quá trình oxi hóa (sự oxi hóa) là quá trình nhường electron.
- Quá trình khử (sự khử) là quá trình thu electron.
1.1.4. Thí dụ 3: Natri cháy trong khí Clo
-
Phương trình hóa học: \({\rm{Na + C}}{{\rm{l}}_{\rm{2}}} \to {\rm{NaCl}}\)
-
Nhận xét:
-
Trong phản ứng, nguyên tử Na nhường electron để trở thành Na+
-
Nguyên tử Cl thu electron để trở thành Cl-
-
Hai ion mang điện tích trái dấu này hút nhau tạo thành hợp chất ion NaCl.
-
- Kết luận: Ở đây xảy ra đồng thời sự oxi hóa Na và sự khử Cl. Trong phản ứng này, cũng xảy ra sự nhường, sự thu electron và có sự thay đổi số oxi hóa.
\(\begin{array}{l} Na \to N{a^ + } + 1e\\ Cl + 1e \to C{l^ - } \end{array}\)
1.1.5. Thí dụ 4: Hidro cháy với khí Clo
- Phương trình hóa học: \(\mathop {{H_2}}\limits^0 + \mathop {C{l_2}}\limits^0 \to 2\mathop H\limits^{ + 1} \mathop {Cl}\limits^{ - 1}\)
- Nhận xét:
- Ở phản ứng này, mỗi nguyên tử H và mỗi nguyên tử Cl góp một electron để hình thành cặp electron chung tạo ra hợp chất cộng hóa trị có cực HCl.
-
Trong phân tử HCl, cặp electron chung bị hút lệch về phía nguyên tử Cl, do nguyên tử Cl có độ âm điện lớn hơn.
-
Trong phản ứng có sự chuyển electron và có sự thay đổi số oxi hóa.
1.1.6. Thí dụ 5: Phản ứng phân hủy NH4NO3
- Phương trình hóa học:
- Nhận xét:
- Ở phản ứng này, nguyên tử \(\mathop N\limits^{ - 3}\) nhường electron, còn nguyên tử \(\mathop N\limits^{ + 5}\) nhận electron.
- Như vậy, chỉ có sự thay đổi số oxi hóa của một nguyên tố.
1.1.7. Kết luận
- Phản ứng oxi hóa khử là phản ứng hóa học, trong đó có sự chuyển electron giữa các chất phản ứng, hay phản ứng oxi hóa khử là phản ứng hóa học trong đó có sự thay đổi số oxi hóa của một số nguyên tố.
- Khái niệm “chất” ở đây được hiểu theo nghĩa rộng, có thể là nguyên tử, phân tử hoặc ion.
-
Sự nhường electron chỉ có thể xảy ra khi có sự nhận electron. Vì vậy, sự oxi hóa và sự khử bao giờ cũng diễn ra đồng thời trong một phản ứng oxi hóa khử.
-
Trong phản ứng oxi hóa khử bao giờ cũng có chất oxi hóa và chất khử tham gia.
1.2. Lập phương trình hóa học của phản ứng oxi hóa khử
1.2.1. Cân bằng theo phương pháp thăng bằng electron
-
Nguyên tắc: tổng số electron do chất khử nhường phải đúng bằng tổng số electron mà chất oxi hóa nhận.
-
Các bước lập phương trình hóa học.
-
Bước 1: Xác định số oxi hóa của các nguyên tố trong phản ứng để tìm chất oxi hóa và chất khử.
-
Bước 2: Viết quá trình oxi hóa và quá trình khử, cân bằng mỗi quá trình.
-
Bước 3: Tìm hệ số thích hợp cho chất oxi hóa và chất khử sao cho tổng số electron do chất khử nhường bằng tổng số electron mà chất oxi hóa nhận.
-
Bước 4: Đặt các hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng. Hoàn thành phương trình hóa học.
-
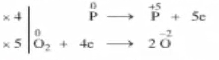
1.2.2. Thí dụ 1: Phản ứng cháy của Phoppho trong Oxi
Phương trình phản ứng: P + O2 → P2O5
- Bước 1: Xác định số oxi hóa của các nguyên tố trong phản ứng để tìm chất oxi hóa và chất khử.
\(\mathop P\limits^0 + \mathop {{O_2}}\limits^0 \to \mathop {{P_2}}\limits^{ + 5} \mathop {{O_5}}\limits^{ - 2}\)
P có số oxi hóa tăng từ 0 đến +5
O có số oxi hóa giảm từ 0 xuống -2
- Bước 2: Viết quá trình oxi hóa và quá trình khử, cân bằng mỗi quá trình.
\(\mathop P\limits^0 \to \mathop P\limits^{ + 5} + 5e\): Quá trình oxi hóa
\(\mathop {{O_2}}\limits^0 + 4e \to 2\mathop O\limits^{ - 2}\): Quá trình khử
- Bước 3: Tìm hệ số thích hợp cho chất oxi hóa và chất khử sao cho tổng số electron do chất khử nhường bằng tổng số electron mà chất oxi hóa nhận.
- Bước 4: Đặt các hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng. Hoàn thành phương trình hóa học.
Phương trình phản ứng: 4P + 5O2 → 2P2O5
1.2.3. Thí dụ 2: Phản ứng giữa khí Cacbon monoxit (CO) khử Sắt (III) oxit ở nhiệt độ cao
Phương trình phản ứng: CO + Fe2O3 .PNG)
- Bước 1: Xác định số oxi hóa của các nguyên tố trong phản ứng để tìm chất oxi hóa và chất khử.
Phương trình phản ứng: \(\mathop {F{e_2}}\limits^{ + 3} \mathop {{O_3}}\limits^{ - 2} + \mathop C\limits^{ + 2} \mathop O\limits^{ - 2} \to \mathop {Fe}\limits^0 + \mathop C\limits^{ + 4} \mathop {{O_2}}\limits^{ - 2}\)
- Bước 2: Viết quá trình oxi hóa và quá trình khử, cân bằng mỗi quá trình.
\(\mathop {Fe}\limits^{ + 3} + 3e \to \mathop {Fe}\limits^0\): Quá trình khử
\(\mathop C\limits^{ - 2} \to \mathop C\limits^{ + 4} + 2e\): Quá trình oxi hóa
- Bước 3: Tìm hệ số thích hợp cho chất oxi hóa và chất khử sao cho tổng số electron do chất khử nhường bằng tổng số electron mà chất oxi hóa nhận.
- Bước 4: Đặt các hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng. Hoàn thành phương trình hóa học.
Phương trình phản ứng: 3CO + Fe2O3 .PNG)
1.3. Ý nghĩa của phản ứng oxi hóa khử trong thực tiễn
-
Trong đời sống: Sự cháy của xăng dầu trong các động cơ đốt trong, sự cháy của than, củi, các quá trình điện phân, các phản ứng xảy ra trong pin, ắc quy...
-
Trong sản xuất: các quá trình sản xuất hóa học như luyện gang, thép, luyện nhôm, sản xuất các hóa chất cơ bản như xút, axit clohđric, axit nitric, sản xuất phân bón, thuốc bảo vệ thực vật, dược phẩm, v.v…
Bài 1:
Lập phương trình hóa học của phản ứng sau:
Fe + HNO3 → Fe(NO3)3 + NO + H2O
Hướng dẫn:
- Bước 1: Xác định số oxi hóa của các nguyên tố trong phản ứng để tìm chất oxi hóa và chất khử.
\(\mathop {{\rm{Fe}}}\limits^{\rm{0}} {\rm{ + H}}\mathop {\rm{N}}\limits^{{\rm{ + 5}}} {{\rm{O}}_{\rm{3}}} \to \mathop {{\rm{Fe}}}\limits^{{\rm{ + 3}}} {{\rm{(N}}{{\rm{O}}_{\rm{3}}}{\rm{)}}_{\rm{3}}}{\rm{ + }}\mathop {{\rm{ N}}}\limits^{{\rm{ + 2}}} {\rm{O + }}{{\rm{H}}_{\rm{2}}}{\rm{O}}\)
- Bước 2: Viết quá trình oxi hóa và quá trình khử, cân bằng mỗi quá trình.
\(\mathop {Fe}\limits^0 \to \mathop {Fe}\limits^{ + 3} {\rm{ }} + 3e\): Quá trình oxi hóa
\(\mathop N\limits^{ + 5} + 3e \to \mathop N\limits^{ + 2}\): Quá trình khử
- Bước 3: Tìm hệ số thích hợp cho chất oxi hóa và chất khử sao cho tổng số electron do chất khử nhường bằng tổng số electron mà chất oxi hóa nhận.
- Bước 4: Đặt các hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng. Hoàn thành phương trình hóa học.
Phương trình hóa học: Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
Bài 2:
Lập phương trình hóa học của phản ứng sau.
Al + HNO3 → Al(NO3)3 + N2O + H2O
Hướng dẫn:
- Bước 1: Xác định số oxi hóa của các nguyên tố trong phản ứng để tìm chất oxi hóa và chất khử.
- Bước 2: Viết quá trình oxi hóa và quá trình khử, cân bằng mỗi quá trình.
\(\mathop {Al}\limits^0 \to \mathop {Al}\limits^{ + 3} + 3e\): Quá trình oxi hóa
\(\mathop N\limits^{ + 5} + 4e \to \mathop N\limits^{ + 1}\): Quá trình khử
- Bước 3: Tìm hệ số thích hợp cho chất oxi hóa và chất khử sao cho tổng số electron do chất khử nhường bằng tổng số electron mà chất oxi hóa nhận.
- Bước 4: Đặt các hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng. Hoàn thành phương trình hóa học.
Phương trình hóa học: \(8Al{\rm{ + 30HN}}{{\rm{O}}_{\rm{3}}} \to {\rm{8Al(N}}{{\rm{O}}_{\rm{3}}}{{\rm{)}}_{\rm{3}}}{\rm{ + 3}}{{\rm{N}}_{\rm{2}}}{\rm{O + 15}}{{\rm{H}}_{\rm{2}}}{\rm{O}}\)
3. Luyện tập Bài 17 Hóa học 10
Sau bài học cần nắm:
- Khái niệm Chất oxi hóa, chất khử, Sự oxi hóa, sự khử, Xác định số oxi hóa của các nguyên tố trong phương trình hóa học.
- Định nghĩa về Phản ứng oxi hóa khử, các bước tiến hành lập phương trình hóa học của phản ứng oxi hóa – khử theo phương pháp thăng bằng electron.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 10 Bài 17 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. 2NO2 + 2NaOH → NaNO3 + NaNO2 + H2O.
- B. AgNO3 + HCl → AgCl + HNO3.
- C. Ca(OH)2 + 2CO2 → Ca(HCO3)2.
- D. 2NaOH + SO2 → Na2SO3 + H2O.
-
- A. 20.
- B. 2.
- C. 11.
- D. 8.
-
- A. 2.
- B. 1.
- C. 4.
- D. 3.
-
- A. Fe(OH)2 là chất khử, O2 là chất oxi hoá.
- B. O2 là chất khử, H2O là chất oxi hoá.
- C. Fe(OH)2 là chất khử, H2O là chất oxi hoá.
- D. Fe(OH)2 là chất khử, O2 và H2O là chất oxi hoá.
Câu 3- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 10 Bài 17.
Bài tập 17.15 trang 43 SBT Hóa học 10
Bài tập 17.16 trang 43 SBT Hóa học 10
Bài tập 17.17 trang 43 SBT Hóa học 10
Bài tập 17.18 trang 43 SBT Hóa học 10
Bài tập 17.19 trang 43 SBT Hóa học 10
Bài tập 1 trang 102 SGK Hóa học 10 nâng cao
Bài tập 2 trang 103 SGK Hóa học 10 nâng cao
Bài tập 3 trang 103 SGK Hóa học 10 nâng cao
Bài tập 4 trang 103 SGK Hóa học 10 nâng cao
Bài tập 5 trang 103 SGK Hóa học 10 nâng cao
Bài tập 6 trang 103 SGK Hóa học 10 nâng cao
Bài tập 7 trang 104 SGK Hóa học 10 nâng cao
4. Hỏi đáp về Bài 17 Chương 4 Hóa học 10
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Copyright © 2021 HOCTAP247