Hoá học 12 Bài 40: Nhận biết một số ion trong dung dịch
Tóm tắt bài
2.1. Nguyên tắc nhận biết ion trong dung dịch
- Dung dịch chứa ion + Thuốc thử:
-
Chất kết tủa
-
Sản phẩm có màu
-
Chất khí khó tan sủi bọt
-
Chất khí bay khỏi dung dịch
-
2.2. Nhận biết một số Cation trong dung dịch
a. Bảng nhận biết
| Cation | Thuốc thử | Hiện tượng | Giải thích |
| Na+ |
Thử màu ngọn lửa |
Ngọn lửa có màu vàng tươi |
Ion Na+ hầu như không kết tủa với các anion khác |
| NH4+ |
Dung dịch kiềm |
Tạo khí NH3 có mùi khai |
\({\rm{NH}}_{\rm{4}}^{\rm{ + }}{\rm{ + O}}{{\rm{H}}^{\rm{ - }}} \to {\rm{N}}{{\rm{H}}_{\rm{3}}} \uparrow {\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}}\) |
| Ba2+ |
Dung dịch H2SO4 dư |
Kết tủa màu trắng | \({\rm{B}}{{\rm{a}}^{{\rm{2 + }}}}{\rm{ + SO}}_{\rm{4}}^{{\rm{2 - }}} \to {\rm{BaS}}{{\rm{O}}_{\rm{4}}} \downarrow\) |
| Al3+ |
Dd kiềm hoặc NH3 |
Kết tủa keo trắng tan trong OH- dư |
\({\rm{A}}{{\rm{l}}^{{\rm{3 + }}}}{\rm{ + 3O}}{{\rm{H}}^{\rm{ - }}} \to {\rm{Al(OH}}{{\rm{)}}_{\rm{3}}} \downarrow\) \({\rm{Al(OH}}{{\rm{)}}_{\rm{3}}}{\rm{ + O}}{{\rm{H}}^{\rm{ - }}} \to {\rm{AlO}}_{\rm{2}}^{\rm{ - }}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}}\) |
| Fe3+ |
Dung dịch kiềm |
Kết tủa nâu đỏ |
\({\rm{F}}{{\rm{e}}^{{\rm{3 + }}}}{\rm{ + 3O}}{{\rm{H}}^{\rm{ - }}} \to {\rm{Fe(OH}}{{\rm{)}}_{\rm{3}}} \downarrow\) |
| Fe2+ |
Dung dịch kiềm |
Kết tủa trắng xanh→đỏ nâu |
\({\rm{F}}{{\rm{e}}^{{\rm{2 + }}}}{\rm{ + 2O}}{{\rm{H}}^{\rm{ - }}} \to {\rm{Fe(OH}}{{\rm{)}}_2} \downarrow\) \({\rm{4Fe(OH}}{{\rm{)}}_{\rm{2}}}{\rm{ + }}{{\rm{O}}_{\rm{2}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {\rm{4Fe(OH}}{{\rm{)}}_{\rm{3}}} \downarrow\) |
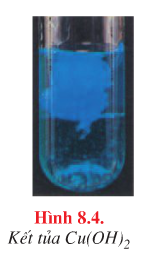
| Cu2+ |
Dung dịch kiềm |
Kết tủa xanh |
\({\rm{C}}{{\rm{u}}^{{\rm{2 + }}}}{\rm{ + 2O}}{{\rm{H}}^{\rm{ - }}} \to {\rm{Cu(OH}}{{\rm{)}}_{\rm{2}}} \downarrow\) |
b. Màu sắc của một số kết tủa
2.3. Nhận biết một số Anion trong dung dịch
a. Bảng nhận biết
| Anion | Thuốc thử | Hiện tượng | Giải thích |
|
NO3- |
Cu / H+ |
Dd có màu xanh, khí thoát ra hóa nâu trong không khí. |
\({\rm{3Cu + 2NO}}_{\rm{3}}^{\rm{ - }}{\rm{ + 8}}{{\rm{H}}^{\rm{ + }}} \to{\rm{3C}}{{\rm{u}}^{{\rm{2 + }}}}{\rm{ + 2NO}} \uparrow {\rm{ + 4}}{{\rm{H}}_{\rm{2}}}{\rm{O}}\) \({\rm{2NO + }}{{\rm{O}}_{\rm{2}}} \to {\rm{2N}}{{\rm{O}}_{\rm{2}}}\) nâu đỏ |
| SO42- |
Dd Ba2+/ H+ dư |
Kết tủa trắng |
\({\rm{B}}{{\rm{a}}^{{\rm{2 + }}}}{\rm{ + SO}}_{\rm{4}}^{{\rm{2 - }}} \to {\rm{BaS}}{{\rm{O}}_{\rm{4}}} \downarrow\) |
| Cl- | Dung dịch AgNO3 |
Kết tủa trắng |
\({\rm{A}}{{\rm{g}}^{\rm{ + }}}{\rm{ + C}}{{\rm{l}}^ - } \to {\rm{AgCl}} \downarrow\) |
| CO32- |
Dd axit mạnh/ Ca(OH)2 |
Kết tủa trắng |
\({\rm{CO}}_{\rm{3}}^{{\rm{2 - }}}{\rm{ + 2}}{{\rm{H}}^{\rm{ + }}} \to {\rm{C}}{{\rm{O}}_{\rm{2}}} \uparrow {\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}}\) \({\rm{C}}{{\rm{O}}_{\rm{2}}}{\rm{ + Ca(OH}}{{\rm{)}}_{\rm{2}}} \to {\rm{CaC}}{{\rm{O}}_{\rm{3}}} \downarrow {\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}}\) |
3.1. Bài tập Nhận biết một số ion trong dung dịch - Cơ bản
Bài 1:
Có các dung dịch không màu đựng trong các lọ riêng biệt, không dán nhãn: ZnSO4, Cu(NO3)2, Al(NO3)3. Để phân biệt các dung dịch trên có thể dùng thuốc thử nào? Nêu các hiện tượng diễn ra.
Hướng dẫn:
Dùng dd Ba(OH)2 vì:
- ZnSO4 tạo kết tủa màu trắng.
\({\rm{Ba(OH}}{{\rm{)}}_{\rm{2}}}{\rm{ + ZnS}}{{\rm{O}}_{\rm{4}}} \to {\rm{BaS}}{{\rm{O}}_{\rm{4}}} \downarrow {\rm{ + Zn(OH}}{{\rm{)}}_{\rm{2}}}\)
- Cu(NO3)2 tạo kết tủa màu xanh.
\({\rm{Cu(N}}{{\rm{O}}_{\rm{3}}}{{\rm{)}}_{\rm{2}}}{\rm{ + Ba(OH}}{{\rm{)}}_{\rm{2}}} \to {\rm{Cu(OH}}{{\rm{)}}_{\rm{2}}} \downarrow {\rm{ + Ba(N}}{{\rm{O}}_{\rm{3}}}{{\rm{)}}_{\rm{2}}}\)
- Al(NO3)3 tạo kết tủa keo.
\({\rm{Al(N}}{{\rm{O}}_{\rm{3}}}{{\rm{)}}_{\rm{3}}}{\rm{ + Ba(OH}}{{\rm{)}}_{\rm{2}}} \to {\rm{Al(OH}}{{\rm{)}}_{\rm{3}}} \downarrow {\rm{ + Ba(N}}{{\rm{O}}_{\rm{3}}}{{\rm{)}}_{\rm{2}}}\)
Bài 2:
Trình bày cách nhận biết các dung dịch trong suốt, trong lọ mất nhãn sau: HCl,HNO3, H2SO4 bằng phương pháp hóa học?
Hướng dẫn:
Trích mỗi chất một ít cho vào 3 ống nghiệm khác nhau và đánh số thứ tự (1), (2), (3).
Lấy dung dịch BaCl2 cho vào 3 ống nghiệm, ống nào cho kết tủa trắng là H2SO4:
\({\rm{BaC}}{{\rm{l}}_{\rm{2}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}} \to {\rm{BaS}}{{\rm{O}}_{\rm{4}}} \downarrow {\rm{ + 2HCl}}\)
Lấy dung dịch AgNO3 cho vào hai ống còn lại, ống nào cho kết tủa trắng sau hóa đen ngoài không khí là chứa axit HCl.
\({\rm{AgN}}{{\rm{O}}_{\rm{3}}}{\rm{ + HCl}} \to {\rm{AgCl}} \downarrow {\rm{ + HN}}{{\rm{O}}_{\rm{3}}}\)
Dung dịch còn lại là HNO3.
Bài 3:
Dùng dung dịch Ba(OH)2 để phân biệt 6 dung dịch NaNO3, Fe(NO3)3, Al(NO3)3, Mg(NO3)2, NH4NO3, (NH4)2SO4 sau thì hiện tượng diễn ra là gì?
Hướng dẫn:
- Fe(NO3)3 tạo kết tủa màu nâu đỏ.
- Al(NO3)3 tạo kết tủa keo.
- Mg(NO3)2 tạo kết tủa trắng.
- NH4NO3 tạo khí mùi khai.
- (NH4)2SO4 tạo kết tủa màu trắng đồng thời có khí mùi khai thoát ra.
3.2. Bài tập Nhận biết một số ion trong dung dịch - Nâng cao
Bài 1:
Có 5 dung dịch mất nhãn : Na2S, BaCl2, AlCl3, MgCl2, Na2CO3. Nếu không dùng thêm thuốc thử thì có thể nhận biết được tối đa số dung dịch là
Hướng dẫn:
Cho từng cặp chất trong bình phản ứng từng đôi một, ta có bảng sau:
|
|
Na2S |
BaCl2 |
AlCl3 |
MgCl2 |
Na2CO3 |
|
Na2S |
- |
- |
↓ keo trắng ↑ mùi trứng thối |
↓ trắng ↑ mùi trứng thối |
- |
|
BaCl2 |
- |
- |
- |
- |
↓ trắng |
|
AlCl3 |
↓ keo trắng ↑ mùi trứng thối |
- |
- |
- |
↓ keo trắng ↑ không mùi |
|
MgCl2 |
↓ trắng ↑ mùi trứng thối |
- |
- |
- |
↓ trắng |
|
NaCO3 |
- |
|
↓ keo trắng ↑ không mùi |
↓ trắng |
- |
Vậy có thể nhận biết cả 5 chất trong 5 lọ mất nhãn.
4. Luyện tập Bài 40 Hóa học 12
4.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hoá học 12 Bài 40 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. HCl
- B. Qùy tím
- C. NaOH
- D. BaCl2
-
- A. 1.
- B. 4.
- C. 2.
- D. 3.
-
- A. BaCl2
- B. NaHSO4.
- C. Ba(OH)2.
- D. NaOH.
-
- A. giấy quỳ tím, dung dịch bazơ.
- B. muối tan Ba2+, Cu kim loại.
- C. Ba(OH)2 và dung dịch muối tan của Ag+
- D. dd phenolphtalein, giấy quỳ tím.
-
- A. Dung dịch KOH.
- B. Dung dịch Na2CO3.
- C. Dung dịch AgNO3.
- D. Dung dịch H2SO4.
-
- A. Dùng muối bari.
- B. Dùng quỳ tím và muối bari.
- C. Dùng dung dịch Ba(OH)2.
- D. Dùng dung dịch AgNO3 và quỳ tím.
-
- A. phương pháp đốt nóng thử màu ngọn lửa.
- B. phương pháp nhiệt phân để tạo kết tủa.
- C. thuốc thử để tạo với ion một sản phẩm kết tủa, bay hơi hoặc có sự thay đổi màu.
- D. phương pháp thích hợp để tạo ra sự biến đổi về trạng thái, màu sắc từ các ion trong dung dịch.
-
- A. dung dịch AgNO3
- B. dung dịch NaOH.
- C. dung dịch Ca(OH)2.
- D. dung dịch Ba(OH)2.
Câu 3- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
4.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hoá học 12 Bài 40.
Bài tập 1 trang 236 SGK Hóa 12 Nâng cao
Bài tập 2 trang 236 SGK Hóa 12 Nâng cao
Bài tập 3 trang 236 SGK Hóa 12 Nâng cao
Bài tập 4 trang 236 SGK Hóa 12 Nâng cao
Bài tập 40.1 trang 95 SBT Hóa học 12
Bài tập 40.2 trang 95 SBT Hóa học 12
Bài tập 40.3 trang 95 SBT Hóa học 12
Bài tập 40.4 trang 95 SBT Hóa học 12
Bài tập 40.5 trang 95 SBT Hóa học 12
Bài tập 40.6 trang 95 SBT Hóa học 12
Bài tập 40.7 trang 95 SBT Hóa học 12
Bài tập 6 trang 174 SGK Hóa học 12
5. Hỏi đáp về Bài 40 Chương 8 Hoá học 12
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Copyright © 2021 HOCTAP247

.PNG)
.PNG)
.PNG)