Tổng hợp kiến thức chuẩn nhất về hidrocacbon - Hóa học 9
Tóm tắt bài
Ở bài viết này gửi đến bạn những kiến thức lý thuyết về hidrocacbon no là gì, hidrocacbon thơm, hidrocacbon không no, nguồn hidrocacbon thiên nhiên, cách đọc (nhận biết) tên gốc hidrocacbon và một số bài tập về hidrocacbon ở cuối bài viết.
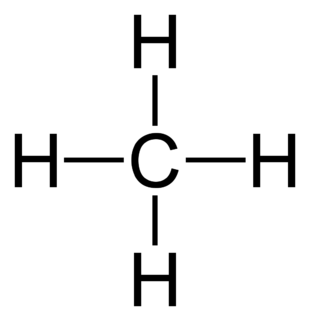
I) Tổng quan về hidrocacbon
1) Định nghĩa
- Hợp chất hữu cơ mà trong phân tử chỉ gồm cacbon (C) và hidro (H) thì được gọi là hidrocacbon.
- Gồm: hidrocacbon no, hidrocacbon không no và hidrocacbon thơm.
2) Công thức chung
\(C_xH_y\)
Trong đó:
- x là số nguyên dương, khác 0
- y là số nguyên dương chăn, khác 0
Ví dụ: \(C_{10}H_4\); \(C_{10}H_6\); ...
3) Tính chất hóa học
a) Phản ứng cháy
- Phản ứng cháy được hiểu là phản ứng oxi hóa hoàn toàn chất đó bằng oxi.
- Đặc điểm:
- Đều tỏa nhiệt
- Phát sáng khi cháy nhanh (hay cháy bùng lên)
- Đều tạo khí \(CO_2\) và \(H_2O\)
b) Phản ứng nhiệt phân
- Là phản ứng mà phân tích chất đó thành hai hay nhiều chất khác nhau dưới tác dụng của nhiệt.
- Đặc điểm: Tạo cacbon và hidro khi đem nung nóng ở nhiệt độ trên \(1000^0C\) với điều kiện cách ly không khí.
- Phương trình phản ứng:
\(C_xH_y \rightarrow xC + \dfrac {y}{2}H_2\)
II) Tìm hiểu chi tiết
Ở phần này chúng ta sẽ đi tìm hiểu chi tiết về hidrocacbon no là gì, hidrocacbon không no, hidrocacbon thơm
1) Hidrocacbon no
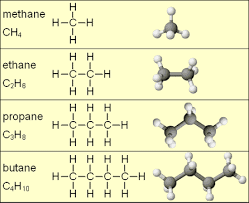
a) Định nghĩa
- Hidrocacbon mà phân tử chỉ có liên kết đơn thì được gọi là hidrocacbon no.
- Gồm:
- Ankan: \(C_nH_{2n+2}\) (\(n \geq 1\))
- Cycloankan: \(C_nH_{2n}\) (\(n \geq 3\))
b) Tính chất vật lí
- Điều kiện thường:
- Thể khí: từ \(C_1\) đến \(C_4\)
- Thể lỏng: từ \(C_5 - C_{18}\)
- Thể rắn: từ \(C_{19}\) trở đi
- \(t^o nc\), \(t^o sôi\) tăng theo chiều tăng của phân tử khối.
- Không tan trong nước nhưng tan nhiều trong dung môi hữu cơ.
c) Tính chất hóa học
- Phản ứng cháy
\(C_nH_{2n+2} + \dfrac {3n+1}{2} O_2 \rightarrow nCO_2 + (n+1) H_2O\)
- Phản ứng thế halogen
Ta xét ví dụ:
\(CH_4 +Cl_2 \rightarrow CH_3Cl + HCl\)
\(CH_3Cl + Cl_2 \rightarrow CH_2Cl_2 + HCl\)
...
Phản ứng sẽ tiếp tục thế halogen (Cl) cho tới hết
- Phản ứng nhiệt phân: Dựa vào từng điều kiện khác nhau mà phản ứng cho sản phẩm khác nhau.
- Với hợp chất thuộc dãy đồng đẳng ankan thì sẽ có phản ứng craking.
2) Hidrocacbon không no
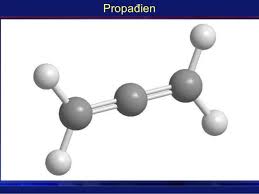
a) Định nghĩa
- Hidrocacbon mà có các liên kết cacbon hai hoặc ba thì được gọi là hidrocacbon không no.
- Gồm:
- 1 liên kết đôi: Anken
- 2 liên kết đôi: Ankadien
- 1 liên kết ba: Ankin
b) Tính chất vật lý
Tồn tại ở ba dạng rắn, lỏng và khí khi:
- Chất khí: từ \(C_1 - C_4\)
- Chất lỏng: \(C_5 - C_{17}\)
- Chất rắn: \(C_{18}\) trở đi
c) Tính chất hóa học
- Phản ứng cháy:
\(C_nH_{2n+2}+O_2\rightarrow nCO_2 + nH_2O\)
- Phản ứng tách hidro:
\(C_nH_{2n+2} \rightarrow C_nH_{2n} + H_2\)
3) Hidrocacbon thơm
- Hidrocacbon mà trong phân tử của chúng có các nhân benzen - \(C_6H_6\) được gọi là hidrocacbon thơm.
- Một số chất thuộc hidrocacbon thơm:
- Benzen
- Toluen
- Naphtalen
- Xilen
- Etylbenzen
- Styren
III) Mở rộng
1) Những nguồn hidrocacbon thiên nhiên
a) Dầu mỏ
- Là một hỗn hợp lỏng
- Màu sắc: nâu đen
- Có mùi đặc trưng
- Nhẹ hơn nước và không tan không nước.
b) Khí dầu mỏ và khí tự nhiên
- Khí dầu mỏ có trong các mỏ dầu (thường được gọi với tên gọi khác là khi đồng hành)
- Khí thiên nhiên là khí chứa trong các mỏ khí riêng biệt.
c) Than mỏ: dùng để làm nhiên liệu, làm phân đạm, sản xuất nhựa than đá.
Trên đây là những nguồn hidrocacbon thiên nhiên mà chúng ta vẫn luôn thường xuyên được nghe, biết đến và thường xuyên gặp.
2) Danh pháp
Có hai cách đọc tên gốc hidrocacbon
- Cách 1: Đọc theo tên thông thường, tức là tên được đặt theo nguồn gốc tìm ra và đôi khi có phần đuôi để chỉ rõ hợp chất thuộc loại nào.
- Cách 2: Đọc tên theo hệ thống danh pháp IUPAC (tên quốc tế)
a) Đọc tên gốc - chức: gồm tên phần gốc_tên phần định chức.
VD: \(C_2H_5 Cl\)_Etylclorua
b) Tên thay thế: Tên phần thế (nếu có) + tên cacbon chính + tên phần định chức
VD: \(CH_3CH_3\)_etan
3) Thứ tự ưu tiên trong mạch cacbon
\(-COOH > -CHO> - OH> -NH_2 > -C=C> -C\equiv CH\)> nhóm thế
IV) Luyện tập bài tập về hidrocacbon
Bài 1: Cho đốt cháy hỗn hợp X: axetilen, etan, propilen có khối lượng 24,8g thì thu được 1,6 mol \(H_2O\). Mặt khác 0,5 mol X tác dụng vừa đủ với dung dịch chứa 0,645 mol \(Br_2\). Hãy tính\(%V_etan\) phần trăm V của etan trong hỗn hợp X?
Hướng dẫn:
Ta lập phương trình dựa vào dữ liệu đề bài đã cho:
\(\left\{\begin{matrix}26a+30b+42=24,8 & & & \\ 2a+6b+6c=3,2 & & & \\ k(a+b+c)=0,5 & & & \\ k(2a+c)=0,645 & & & \end{matrix}\right.\)
Giải hệ phương trình ta được kết quả bằng 5%
Bài 2: Cho hỗn hợp khí X (\(H_2 \) và \(C_2H_4\)) có tỉ số khối so với He là 3,75. Dẫn X qua Ni nung nóng thì thu được hôn hợp khí Y có tỉ khối so với He là 5. Hỏi hiệu suất phản ứng hidro hóa bằng bao nhiêu?
Hướng dẫn:
\(m_X = m_Y = 30 \rightarrow n_Y=\dfrac {30}{20} = 1,5 \rightarrow \Delta n = 0,5\)
Suy ra hiệu suất phản ứng hidro hóa: 50%
Xem thêm>>> Hướng dẫn bài tập SGK
Trên đây là bài viết mà đã tổng hợp được về những kiến thức như hidrocacbon no là gì, hidrocacbon thơm, hidrocacbon không no, mở rộng thêm về nguồn hidrocacbon thiên nhiên, cách đọc tên gốc hidrocacbon và một số bài tập về hidrocacbon. Hãy like và share nếu thấy bài viết hữu ích nhé!
Copyright © 2021 HOCTAP247
