Tổng hợp lý thuyết liên kết ion - Hóa học 10
Tóm tắt bài
gửi đến bạn bài viết tổng hợp lý thuyết về liên kết ion, trong bài sẽ đưa ra những khái niệm cơ bản như liên kết ion là gì, phân biệt liên kết ion và liên kế công hóa trị, liên kết ion - tinh thể ion. Mong rằng sau bài viết bạn có thể tự giải thích sự hình thành liên kế ion.
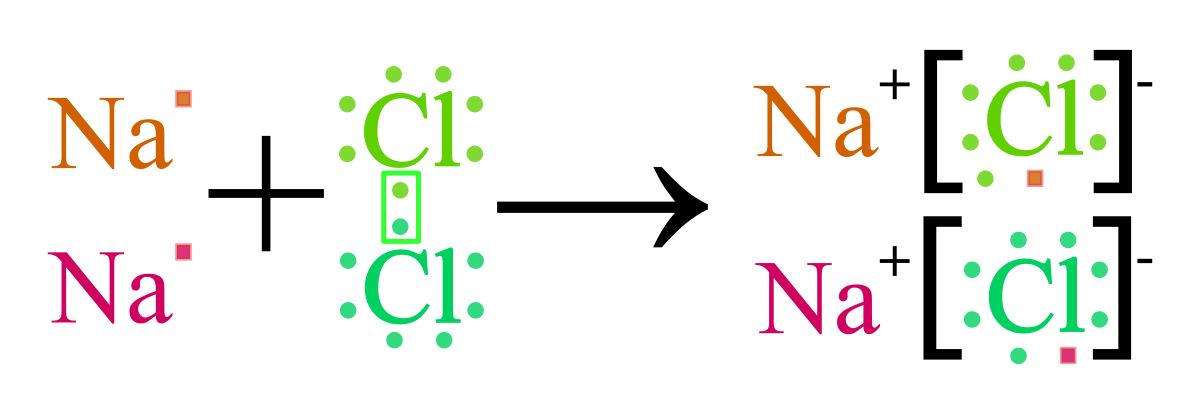
I) Tổng quát
1) Ion, cation, anion
- Khi số proton mang điện dương bằng số electron mang điện âm nhường hay nhận e để trở thành phần tử mang điện được gọi là ion.
- Với mục đích là để đạt được cấu hình bền của khí hiếm trong phương trình hóa học , những nguyên tử kim loại có khuynh hướng nhường e cho nguyên tử các nguyên tố khác để trở thành phần tử mang điện dương được gọi là Cation.
Ví dụ: \(Li \rightarrow Li^+ + 1e\)
- Để đạt cấu hình bền của khí hiếm trong phương trình hóa học thì những nguyên tử phi kim có khuynh hướng nhận thêm e của nguyên tử các nguyên tố khác để trở thành phân tử mang điện âm thì được gọi là Anion.
Ví dụ: \(F + 1e\rightarrow F^-\)
♦ Chú ý: Quy tắc bát tử các nguyên tử của các nguyên tố có khuynh hướng liên kết với các nguyên tử khác để đát được cấu hình bền vững của khí hiệu với 8 e ( với Heli là 2e) ở lớp ngoài cùng.
2) Thế nào là ion đơn nguyên tử và ion đa nguyên tử.
- Ion được tạo nên từ 1 nguyên tử được gọi là ion đơn nguyên.
- Những nhóm nguyên tử mang điện tích dương (hay âm) tạo nên ion thì được gọi là ion đa nguyên.
VD:
- Ion đơn nguyên: \(LI^+; Na^+; Mg^{2+}; F^-; Cl^-\)
- Ion đa nguyên: \(NH_4^+; OH^-; SO_4^{2-}\)
II) Khái niệm liên kết ion là gì?
- Hiểu một cách đơn giản thì liên kết mà hình thành bởi những lực hút tĩnh điện giữa các ion mang điện trái dấu (dương âm) gọi là liên kết ion.
- Tính chất:
- Có liên kết hóa học mạnh
- Khi phá vỡ cần tiêu tốn nguồn năng lượng rất lớn.
- Ví dụ: Quá trình hình thành phân tử NaCl
Từ phương trình ion trên ta có thể thấy hai ion được tạo thành là \(Na^+\) và \(Cl^-\) mang điện tích trái dấu và hút nhau bằng lực hút tĩnh điện, tạo nên phân tử \(NaCl\).
\(Na^+ + Cl^- \rightarrow NaCl\)
III) Cách phân biệt liên kết ion và liên kết cộng hóa trị
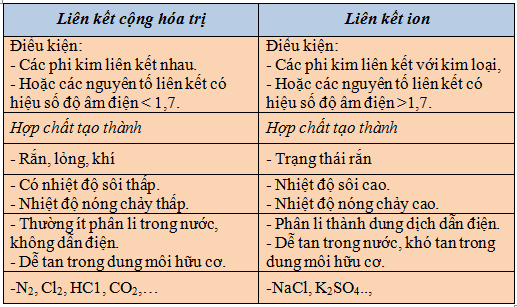
(Bảng phân biệt liên kết ion và liên kết cộng hóa trị)
Có thể bạn quan tâm: Bài tập liên kết cộng hóa trị
IV) Tinh thể ion
- Ở đkt, hợp chất ion thường tồn tại ở dạng tinh thể.
- Tính chất:
- Ngoài tinh thể \(NaCl\) ra thì các tinh thể khác rất bền vững, \(t^0_{nc}\) cao.
- Tan nhiều trong \(H_2O\). Đồng thời chúng phân phi thành ion khi ở trong nước.
- Tinh thể ion có thể dẫn điện.
- Nhờ lực hút tĩnh điện mà các ion liên kết với nhau.
V) Luyện tập
Câu 1: Hãy lập bảng phân biệt cation với anion, ion đơn nguyên tử với ion đa nguyên tử.
Câu 2: Cho phân tử \(MgO\), hãy giải thích sự hình thành liên kết ion của phân tử.
Câu 3: Cho hai nguyên tử là Liti (Z = 3), Oxi (Z = 8). Hãy viết cấu hình e của 2 ion \(Li^+; O^{2-}\)
Câu 4: Trong các hợp chất dưới đây: \(NH_3; H_2O, K_2S; MgCl_2; Na_2OCH_4\). Hợp chất nào có liên kết ion? Và giải thích sự hình thành liên kết ion của từng hợp chất trên.
Xem thêm >>> Hướng dẫn bài tập
Trên đây là bài viết mà đã tổng hợp được, đừng ngại ngần mà để lại những câu hỏi thắc mắc của bản thân ở phía dưới comment nhé! Chúc các bạn học tập tốt
Copyright © 2021 HOCTAP247
