Tổng hợp đầy đủ lý thuyết về nito - Có thể bạn chưa biết
Tóm tắt bài
Để làm tốt các bài tập Hóa học lớp 11, không thể bỏ qua chủ đề Nito. Trong bài viết dưới đây, cunghocvui.com sẽ giúp cho chúng ta biết: Nito hóa trị mấy? Khí nito có độc không?...
I. Cấu hình electron nguyên tử
- Vị trí nitơ: ô thứ 7, chu kỳ 2, nhóm VA trong bản tuần hoàn hóa học.
- Nguyên tử khối của nito: 14
- Hóa trị: I, II, III, IV...
- Cấu hình electron: \(1s^22s^22p^3\).
- Cấu tạo phẩn tử:
+ Công thức phân tử: \(N_2\).
+ Công thức cấu tạo: \(N \equiv N\).
+ Số oxi hóa: -3, 0, +1, +2, +3, +4, +5.
II. Tính chất vật lý
- Chất khí không màu, không vị, không mùi.
- Nhẹ hơn không khí (d = 28/29), hóa lỏng ở nhiệt độ \(-196^oC\), hóa rắn ở nhiệt độ \(-210^0C\).
- Rất ít tan trong nước, hóa lỏng và hóa rắn ở nhiệt độ rất thấp.
- Không độc
III. Tính chất hóa học
Vì phân tử chứa liên kết ba rất bền vững nên ở điều kiện thường, nito là chất ít hoạt động chỉ tham gia phản ứng ở nhiệt độ cao nên nito vừa là chất khử vừa là chất oxi hóa.
1. Tính oxi hóa
- Tác dụng với kim loại tạo ra muối nitrua.
+ Tác dụng với Li ở nhiệt độ thường:
\(6Li + N_2 \rightarrow 2Li_3N\)
+ Phản ứng với một số kim loại ở nhiệt độ cao:
\(2Al + N_2 \rightarrow 2AlN\)
\(3Ca + N_2 \rightarrow Ca_3N_2\)
+ Tác dụng với \(H_2 \) \(\rightarrow \) Amoniac
\(N_2 + 3H_2 \rightarrow 2NH_3\)(>400\(^oC\); Fe; p); \(\Delta \)H = -92kJ
b) Tính khử
\(N_2 + O_2 \rightarrow 2NO\) (xảy ra ở nhiệt độ 3000\(^oC\) hoặc có tia lửa điện).
\(2NO + O_2 \rightarrow 2NO_2\)
IV. Quá trình chuyển hóa nito trong đất
Chuyển hóa nito hữu cơ trong đất thành dạng nito khoáng:
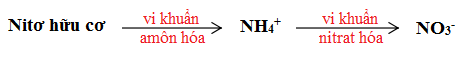
1. Quá trình amôn hóa
Các axit amin nằm trong hợp chất mùn sẽ bị sinh vật trong đất phân giải tạo thành \(NH_4^+\).
- Chất hữu cơ trong đất \(\rightarrow \) \(RNH_2 + CO_2\) + phụ phẩm
- \(RNH_2 + H_2O \rightarrow NH_3 + ROH\)
- \(NH_3 + H_2O \rightarrow NH_4^+ + OH^-\)
2. Quá trình nitrat hóa
Quá trình nitrat diễn ra như sau:
- \(2NH_3 + 3O_2 \rightarrow 2HNO_2 + H_2O\)
- \(2HNO_2 + O_2 \rightarrow 2HNO_3\)
IV. Điều chế
- Trong phòng thí nghiệm: muối amoni nitrit nhiệt phân.
\(NH_4NO_2 \rightarrow N_2 + 2H_2O (t^o)\)
\(NH_4Cl + NaNO_2 \rightarrow N_2 + NaCl + 2H_2O (t^o)\)
- Trong công nghiệp: chưng cất phân đoạn không khí lỏng.
V. Nhận biết
Nito thường được để lại nhận biết sau cùng trong các bài tập.
VI. Trạng thái tự nhiên và ứng dụng
*Trạng thái tự nhiên:
- Trong tự nhiên, khí nito tồn tại ở dạng tự do và trong hợp chất:
+ Dạng tự do: chiếm 80% thể tích không khí.
+ Dạng hợp chất: có nhiều ở dạng \(NaNO_3\) (diêm tiêu natri), thành phần protein,...
*Ứng dụng:
- Hỗ trợ sản xuất phân đạm...
- Tạo môi trường trơ công nghiệp luyện kim.
- Có thể bảo quản máu và các mẫu sinh học khác với nito lỏng.
Xem thêm: Các kiến thức về nhóm nito.
Trên đây là các kiến thức về nito, rất mong bổ ích đối với độc giả!
Copyright © 2021 HOCTAP247
