Lý thuyết về điều chế kim loại - Hóa học 12
Tóm tắt bài
Trong bài sẽ tổng hợp các lý thuyết về điều chế kim loại như nguyên tắc điều chế kim loại, các phương pháp điều chế kim loại và bài tập điều chế kim loại giúp bạn luyện tập ngay sau lý thuyết <3
I) Nguyên tắc điều chế kim loại
Khử ion kim loại thành kim loại, đây là nguyên tắc chung điều chế kim loại
\(M^{n+} + ne \rightarrow M\)
II) Các phương pháp điều chế kim loại
1) Điều chế kim loại bằng phương pháp nhiệt luyện
- Nguyên tắc: sử dụng chất khử \(CO, C, Al, H_2\) để khử oxit kim loại ở nhiệt độ cao
- Phạm vi: dùng trong công nghiệm với các kim loại sau \(Al\) (\(Zn, Fe, Sn, Pb,...\))
Ví dụ:
\(Fe_2O_3 + 3CO \overset{t^0}{\rightarrow} 2Fe + 3CO_2\)
\(PbO + C \overset{t^0}{\rightarrow} Pb + CO\)
- Với kim loại kiềm và kim loại kiềm thổ làm chất khử, điều kiện thực kiện là trong môi trường khí trơ hoặc chân không.
- Còn quặng là sunfua kim loại (\(Cu_2S, ZnS, FeS_2,...\)) thì phải chuyển thành oxit kim loại rồi mới khử bằng chất khử thích hợp
Ví dụ:
(1) \( 2ZnS + 3O_2 \rightarrow 2ZnO + 2SO_2\)
(2) \(ZnO + C \rightarrow Zn + CO\)
- Với \(Cr\) là kim loại khó nóng chảy thì người ta dùng Al để khử (phản ứng nhiệt nhôm)
Ví dụ: \(Cr_2O_3+2Al\rightarrow2Cr + Al_2O_3\)
- Với những kim loại hoạt động kém chỉ cần đốt cháy
Ví dụ: \(HgS + O_2 \rightarrow Hg + SO_2\)
2) Điều chế kim loại bằng phương pháp thủy luyện
- Nguyên tắc:
+) Sử dụng dung dịch (\(HCl, HNO_3, H_2SO_4, NaOH,...\)) thích hợp để hòa tan nguyên liệu
+) Dùng kim loại mạnh không tan trong nước để đẩy kim loại yếu khỏi dung dịch
- Phạm vi: Sau Mg (những kim loại yếu), thường dùng trong phòng thí nghiệm
Ví dụ:
(1) \(Ag_2S + 4NaCN \rightarrow 2Na[Ag(CN)_2] + Na_2S\)
(2) \(Zn + 2Na[Ag(CN)_2] \rightarrow Na_2[ZN(CN)_4] + 2Ag(kt)\)
3) Điều chế kim loại bằng phương pháp điện phân
Phương pháp điện phân được chia thành 2 phương pháp:
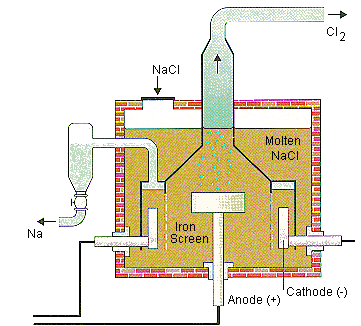
3.1) Điện phân nóng chảy
- Nguyên tắc: Sử dụng dòng điện một chiều để khử ion kim loại trong chất điện li nóng chảy (muối halogenua, oxit, hidroxit)
- Phạm vi: Dùng cho tất cả kim loại, nhưng thường dùng với (\(K, Na, Mg, Ca, Ba, Al\))
Ví dụ: Điện phân nóng chảy \(Al_2O_3\)
| Chất khử | Chất oxh |
| \(Al^{3+} + 3e \rightarrow Al\) | \(2O^{2-} \rightarrow O_2 + 4e\) |
=> Phương trình điện phân nóng chảy: \(Al_2O_3 \rightarrow 4Al + 3O_2\)
3.2) Điện phân dung dịch
- Nguyên tắc: Sử dụng dòng điện một chiều khử ion kim loại yếu trong dung dịch muối
- Phạm vi: Các kim loại yếu
Ví dụ: Điện phân dung dịch \(CuCl_2\)
| Chất khử | Chất oxh |
| \(Cu^{2+} + 2e \rightarrow Cu\) | \(2Cl^{2-} \rightarrow Cl_2 + 2e\) |
=> Phương trình điện phân dung dịch: \(CuCl_2 \rightarrow Cu + Cl_2\)
III) Bài tập
Câu 1: Hãy cho biết đâu là nguyên tắc chung được dùng để điều chế kim loại?
A. Tạo ra sự tác dụng giữa chất chứ ion kim loại với chất khử
B. Oxh ion kim loại thành kim loại
C. Tạo ra sự tác dụng giữa chất chứ ion kim loại với chất oxh
D.Khử ion kim loại thành kim loại
=> Đáp án đúng: D
Câu 2: Trong điều chế kim loại, ion kim loại đóng vai trò là chất gì?
A. nhận electron
B. cho proton
C. bị khử
D. bị oxh
=> Đáp án đúng: C
Câu 3: Hãy chọn trong 4 đáp án dưới đây, đâu là 2 kim loại cùng dãy mà đều có thể điều chế được bằng phương pháp thủy luyện?
A. Ag và Cu
B. Fe và Mg
C. Mg và Cu
D. S và K
=> Đáp án đúng: A
Câu 4: Cho 4 kim loại sau, hãy chọn kim loại có thể điều chế bằng phương pháp thủy luyện?
A. Fe
B. Cu
C. Ag
D. Cả ba đáp án trên
=> Đáp án đúng: D
Câu 5: Đâu là dãy ion kim loại sẽ bị Zn khử thành kim loại?
A. \(Cu^{+2}; Mg^{+2}; Pb^{2+}\)
B. \(Sn^{2+}; Pb{2+}; Cu^{2+}\)
C. \(Pb^{2+}; Ag^{+}; Al^{3+}\)
D. \(Mg^{2+}; Na^+; Al^{3+}\)
=> Đáp án đúng: B
Xem thêm >>> Bài tập điều chế kim loại
Hy vọng sau bài viết tổng hợp về điều chế kim loại này có thể giúp bạn nắm được phương pháp điều chế kim loại nhóm 2A, 1A,... Nếu có bất kỳ thắc mắc hoặc ý kiến đóng góp đến thì bạn hãy để phía bên dưới nhé! Chúc các bạn học tập tốt <3
Copyright © 2021 HOCTAP247
