Hoá học 9 Bài 39: Benzen
Tóm tắt bài
1.1. Tính chất vật lí
- Chất lỏng, không màu, không tan trong nước, nhẹ hơn nước, hoà tan nhiều chất nhiều chất như dầu ăn, nến cao su, iốt
- Benzen độc
Hình 1: Benzen không tan trong nước
1.2. Cấu tạo phân tử
Hình 2: Công thức cấu tạo của benzen
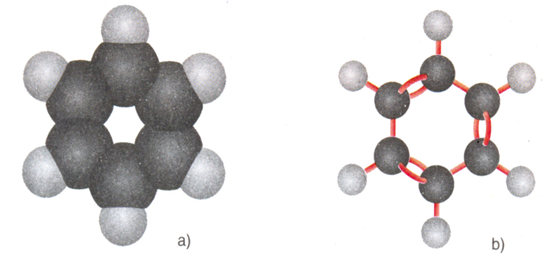
- Trong CTCT của benzen có 3 liên kết đôi và 3 liên kết đơn xen kẽ nhau.
Hình 3: Mô hình phân tử Benzen
a) Dạng đặc b) Dạng rỗng
1.2.1. Benzen có cháy không?
Video 1: Đốt cháy Benzen
-
Benzen dễ cháy tạo ra CO2 và nước: 2C6H6 + 15O2 → 12CO2 +6H2O
1.2.2. Benzen có pứ thế với Br2 không?
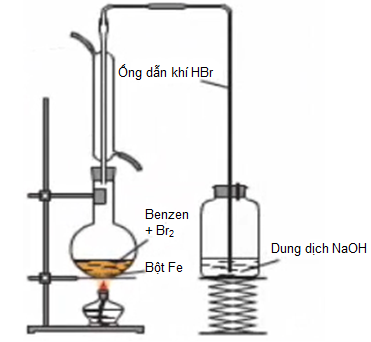
- Cách tiến hành:
Hình 4: Thí nghiệm Benzen tác dụng với Brom có mặt bột Fe
- Hiện tượng: Màu nâu đỏ của Brom bị mất đi, có khí không màu thoát ra.
- Giải thích: Benzen đã phản ứng với Brom có bột Fe làm xúc tác, tạo khí HBr không màu.
- Phương trình phản ứng: C6H6 + Br2
C6H5Br (brombenzen) + HBr
1.2.3. Benzen có phản ứng cộng không?
- Benzen không tác dụng với Brom trong dung dịch, chứng tỏ benzen khó tham gia phản ứng cộng hơn etilen và axetilen. Tuy nhiên, trong điều kiện thích hợp. benzen có phản ứng cộng với một số chất như:
C6H6 + 3H2 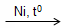
- Kết luận: Do phân tử có cấu tạo đặc biệt nên benzen vừa có phản ứng thế, vừa có phản ứng cộng. Tuy nhiên, phản ứng cộng của benzen xảy ra khó hơn so với etilen và axetilen.
1.2.4. Ứng dụng
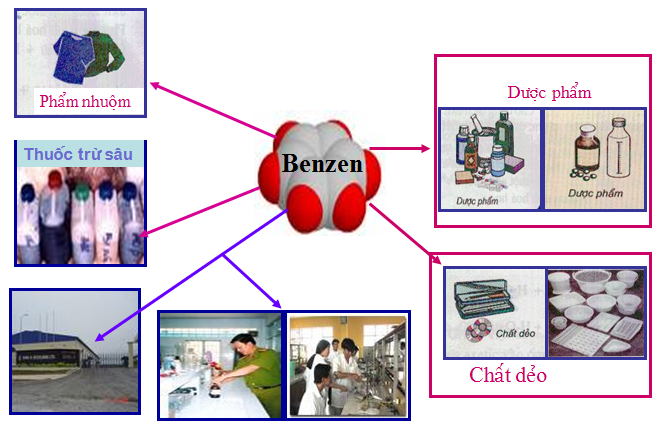
Hình 5: Ứng dụng của benzen
1.3. Tổng kết
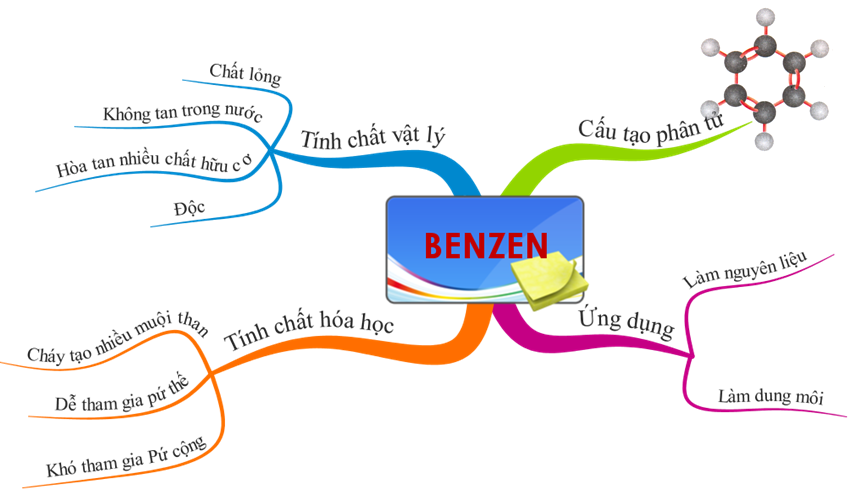
Hình 6: Sơ đồ tư duy bài Benzen
2. Luyện tập Bài 39 Hóa học 9
Sau bài học cần nắm:
- CTPT, CTCT, đặc điểm cấu tạo của benzen.
- Tính chất vật lí: Trạng thái, màu sắc, tính tan trong nước, khối lượng riêng, nhiệt độ sôi, độc tính.
- Tính chất hoá học của C6H6: Phản ứng thế với Br2 lỏng (có bột sắt, đun nóng), pứ cháy, pứ cộng hiđro và clo.
- Benzen được dùng làm nhiên liệu và dung môi trong tổng hợp hữu cơ.
2.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 9 Bài 39 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
Câu 1:
Trong phân tử benzen có:
- A. 6 liên kết đơn, 3 liên kết đôi.
- B. 12 liên kết đơn, 3 liên kết đôi.
- C. 9 liên kết đơn, 3 liên kết đôi.
- D. 9 liên kết đơn, 6 liên kết đôi.
-
- A. Metan
- B. Etilen
- C. Axetilen
- D. Benzen
-
- A. Vòng 6 cạnh, 6 liên kết đơn.
- B. Vòng 6 cạnh , 3 liên kết đôi xen kẽ với 3 liên kết đơn.
- C. Vòng 6 cạnh , 2 liên kết đôi xen kẽ với 4 liên kết đơn.
- D. Vòng 6 cạnh , 4 liên kết đôi xen kẽ với 2 liên kết đơn.
Câu 3- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
2.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 9 Bài 39.
Bài tập 1 trang 125 SGK Hóa học 9
Bài tập 2 trang 125 SGK Hóa học 9
Bài tập 3 trang 125 SGK Hóa học 9
Bài tập 4 trang 125 SGK Hóa học 9
Bài tập 39.1 trang 49 SBT Hóa học 9
Bài tập 39.2 trang 49 SBT Hóa học 9
Bài tập 39.3 trang 49 SBT Hóa học 9
Bài tập 39.4 trang 49 SBT Hóa học 9
Bài tập 39.5 trang 49 SBT Hóa học 9
Bài tập 39.6 trang 49 SBT Hóa học 9
Bài tập 39.7 trang 49 SBT Hóa học 50
3. Hỏi đáp về Bài 39 chương 4 Hóa học 9
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Copyright © 2021 HOCTAP247

.PNG)
.PNG)