Hoá học 8 Bài 4: Nguyên tử
Tóm tắt bài
1.1. Nguyên tử là gì?
- Nguyên tử là những hạt vô cùng nhỏ, trung hòa về điện.
- Nguyên tử gồm:
-
1 hạt nhân mang điện tích dương.
-
Vỏ tạo bởi 1 hay nhiều electron mang điện tích âm.
- Kí hiệu: e
- Điện tích:-1
- Khối lượng:9,1095.10-28g
-
- Tổng điện tích dương của hạt nhân bằng tổng điện tích âm của các electron.
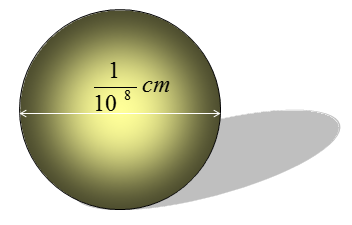
Hình 1: Kích thước nguyên tử
1.2. Hạt nhân nguyên tử
Hình 2: Cấu tạo hạt nhân nguyên tử
Hạt nhân nguyên tử tạo bởi các hạt proton và nơtron.
a. Hạt proton
- Kí hiệu: p
- Điện tích: +1
- Khối lượng: 1,6726.10-24g
b. Hạt nơtron
- Kí hiệu: n
- Điện tích: không mang điện.
- Khối lượng: 1,6726.10-24g
Trong mỗi nguyên tử:
Số p = số e
1.3. Lớp electron
- Trong nguyên tử các electron chuyển động rất nhanh quanh hạt nhân và sắp xếp thành từng lớp, mỗi lớp có 1 số electron nhất định
-
Số lớp electron của nguyên tử:
-
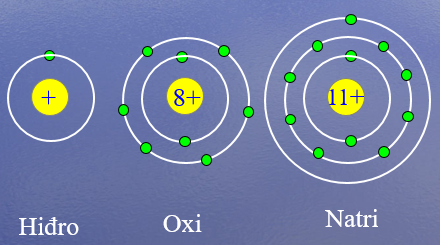
H2 : 1 (1e) → 1e ngoài cùng .
-
O2 : 2 (8e) → 6e ngoài cùng.
-
Na : 3 (11e) →1e ngoài cùng.
-
-
Số e tối đa ở lớp 1: 2e
-
Số e tối đa ở lớp 2: 8e
Hình 3: Cấu tạo nguyên tử Hidro, Oxi, Nitơ
3. Luyện tập Bài 4 Hóa học 8
Sau bài học cần nắm: Xác định được số đơn vị điện tích hạt nhân, số p, số e, số lớp e, số e trong mỗi lớp dựa vào sơ đồ cấu tạo nguyên tử của một vài nguyên tố cụ thể (H, C, Cl, Na).
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 8 Bài 4 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. vô cùng nhỏ
- B. tạo ra chất
- C. trung hòa về điện
- D. không chia nhỏ được
-
- A. 4.
- B. 3.
- C. 2.
- D. 1.
-
- A. Electron
- B. Proton
- C. Nơtron
- D. Hạt nhân.
Câu 2- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 8 Bài 4.
Bài tập 1 trang 15 SGK Hóa học 8
Bài tập 2 trang 15 SGK Hóa học 8
Bài tập 3 trang 15 SGK Hóa học 8
Bài tập 4 trang 15 SGK Hóa học 8
Bài tập 5 trang 15 SGK Hóa học 8
Bài tập 4.1 trang 4 SBT Hóa học 8
Bài tập 4.2 trang 5 SBT Hóa học 8
Bài tập 4.3 trang 5 SBT Hóa học 8
Bài tập 4.4 trang 5 SBT Hóa học 8
Bài tập 4.5 trang 5 SBT Hóa học 8
Bài tập 4.6 trang 6 SBT Hóa học 8
4. Hỏi đáp về Bài 4 chương 1 Hóa học 8
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Copyright © 2021 HOCTAP247