Hoá học 8 Bài 6: Đơn chất và hợp chất - Phân tử
Tóm tắt bài
1.1. Đơn chất
1.1.1. Đơn chất là gì?
Hình 1: Ví dụ một vài đơn chất kim loại
Hình 2: Ví dụ một vài đơn chất phi kim
Khí oxi tạo nên từ nguyên tố O.
Kim loại Natri tạo nên từ nguyên tố Na.
Kim loại nhôm tạo nên từ nguyên tố Al.
Vậy khí oxi, kim loại Na, Al gọi là đơn chất.
⇒ Định nghĩa: Đơn chất do 1 nguyên tố hoá học cấu tạo nên.
- Đơn chất kim loại: Dẫn điện, dẫn nhiệt, có ánh kim.
- Đơn chất phi kim: Không dẫn điện, dẫn nhiệt, không có ánh kim.
*Kết luận: Đơn chất do 1 Nguyên tố hóa học cấu tạo nên. Gồm 2 loại đơn chất :
- Kim loại.
- Phi kim.
1.1.2. Đặc điểm cấu tạo
Hình 3: Mô hình tượng trưng một mẫu kim loại Đồng (rắn)
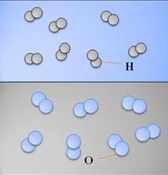
Hình 4: Mô hình tượng trưng một mẫu khí Hidro và Oxi
- Đơn chất Kim loại: Nguyên tử sắp xếp khít nhau và theo một trật tự xác định.
- Đơn chất Phi kim: Nguyên tử liên kết với nhau theo một số nhất định (Thường là 2).
1.2. Hợp chất:
1.2.1. Hợp chất là gì?
- Ví dụ:
- Nước: H2O gồm nguyên tố H và O.
- Muối ăn: NaCl gồm nguyên tố Na và Cl.
- Axit sunfuric: H2SO4 gồm nguyên tố H, S và O.
- Định nghĩa: Hợp chất là những chất tạo nên từ 2 Nguyên tố hóa học trở lên.
- Hợp chất gồm:
- Hợp chất vô cơ: H2O, NaOH, NaCl, H2SO4...
- Hợp chất hữu cơ: CH4 (Mêtan), C12H22O11 (đường), C2H2 (Axetilen), C2H4 (Etilen)...
1.2.2. Đặc điểm cấu tạo
Hình 5: Một số mô hình hợp chất
1) Mô hình phóng đại tượng trưng một mẫu muối ăn (rắn)
2) Mô hình phóng đại tượng trưng một mẫu nước (lỏng)
3) Mô hình phóng đại tượng trưng một mẫu khí Cacbonic (khí)
- Trong hợp chất: Nguyên tố liên kết với nhau theo một tỷ lệ và một thứ tự nhất định
1.3. Phân tử
1.3.1. Định nghĩa:
- Ví dụ:
- Khí hiđro, oxi : 2 nguyên tử cùng loại liên kết với nhau.
- Nước : 2H liên kết với 1 O.
- Muối ăn: 1Na liên kết với 1Cl.
- Định nghĩa: Phân tử là hạt đại diện cho chất, gồm một số nguyên tử liên kết với nhau và thể hiện đầy đủ tính chất hoá học của chất.
1.3.2. Phân tử khối
- Phân tử khối là khối lượng của một phân tử tính bằng đơn vị Cacbon.
- Ví dụ:
-
O2 = 2.16 = 32 đvC
-
Cl2 = 35,5.2 = 71 đvC.
-
CaCO3 = 40 + 12 + 16.3 = 100 đvC
-
H2SO4 = 1.2+32 + 16.4 = 98 đvC.
-
1.4. Trạng thái tự nhiên
- Mỗi mẫu chất là một tập hợp vô cùng lớn những hạt nguyên tử hay phân tử .
- Tuỳ điều kiện môĩ chất có thể ở 3 trạng thái: rắn, lỏng, khí.ở trạng thái khí các hạt cách xa nhau.
Bài 1:
So sánh đơn chất và hợp chất
Hướng dẫn:
- Giống nhau: Tạo nên từ nguyên tố hóa học
- Khác nhau:
- Số lượng nguyên tố:
- Đơn chất: tạo nên từ 1 nguyên tố hóa học
- Hợp chất: tạo nên từ 2 nguyên tố hóa học trở lên
- Cấu tạo:
- Đơn chất: Gồm những nguyên tử cùng loại liên kết với nhau
- Hợp chất: Gồm những nguyên tử khác loại liên kết với nhau
Bài 2:
Tính phân tử khối của các chất sau đây: HCl, SO2, NaCl, KOH
Hướng dẫn:
HCl = 1 + 35,5 = 36,5 đvC
SO2 = 32 + 16.2 = 64 đvC
NaCl = 23 + 35,5 =58,5 đvC
KOH = 39 + 16 + 1 = 56 đvC
(Nguyên tử khối của nguyên tố hóa học các em tra ở bảng tuần hoàn)
H = 1; C = 12; N = 14; O = 16; Na = 23; Al = 27; S = 32; Cl = 35,5; K = 39; Fe = 56; Cu = 64; Zn = 65; Ag = 108; Ba=137.
3. Luyện tập Bài 6 Hóa học 8
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Đơn chất và hợp chất - Phân tử có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. nhôm, đồng, lưu huỳnh, bạc
- B. sắt, chì, kẽm , thủy ngân
- C. oxi, nitơ, cacbon,canxi
- D. vàng , magie, nhôm ,clo
-
- A. oxi, nhôm, đồng, lưu huỳnh, bạc
- B. sắt, chì, kẽm , thủy ngân
- C. oxi, nitơ, cacbon,clo
- D. vàng , magie, nhôm ,clo
-
- A. nước
- B. muối ăn
- C. thủy ngân
- D. khí cacbonic
-
- A. oxi
- B. nhôm
- C. Photpho
- D. Đá vôi
Câu 2- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Đơn chất và hợp chất - Phân tử.
Bài tập 5 trang 26 SGK Hóa học 8
Bài tập 6 trang 26 SGK Hóa học 8
Bài tập 7 trang 26 SGK Hóa học 8
Bài tập 8 trang 26 SGK Hóa học 8
Bài tập 6.1 trang 8 SBT Hóa học 8
Bài tập 6.2 trang 8 SBT Hóa học 8
Bài tập 6.3 trang 8 SBT Hóa học 8
Bài tập 6.4 trang 8 SBT Hóa học 8
Bài tập 6.5 trang 8 SBT Hóa học 8
Bài tập 6.6 trang 9 SBT Hóa học 8
Bài tập 6.7 trang 9 SBT Hóa học 8
Bài tập 6.8 trang 9 SBT Hóa học 8
4. Hỏi đáp về Bài 6 chương 1 Hóa học 8
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Copyright © 2021 HOCTAP247