Hoá học 10 Bài 1: Thành phần nguyên tử
Tóm tắt bài
1.1. Thành phần cấu tạo của nguyên tử
1.1.1.Electron
a. Sự tìm ra electron
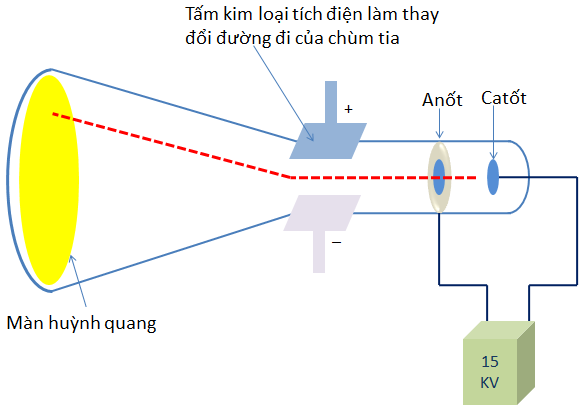
- Năm 1897, J.J. Thomson (Tôm-xơn, người Anh ) đã tìm ra tia âm cực gồm những hạt nhỏ gọi là electron(e).
Hình 1: Sơ đồ thí nghiệm của Tôm-xơn phát hiện ra tia âm cực
Kết luận:
- Tia âm cực là chùm hạt vật chất có khối lượng và chuyển động với vận tốc rất lớn.
- Tia âm cực là chùm hạt mang điện âm,phát ra từ cực âm ,các hạt tạo thành tia âm cực được gọi là các electron (ký hiệu là e).
- Electron có mặt ở mọi chất, electron tạo nên lớp vỏ nguyên tử của mọi nguyên tố hóa học.
- Tia âm cực bị lệch trong từ trường và mang điện tích âm.
b, Khối lượng, điện tích electron
- me = 9,1094.10-31kg.
- qe = -1,602.10-19 C (coulomb) = -1 (đvđt âm, kí hiệu là – e0).
1.1.2. Cấu tạo hạt nhân nguyên tử
- Năm 1911, nhà vật lí người Anh Rutherford và các cộng sự cho các hạt a bắn phá một lá vàng mỏng.
- Từ đó nhận thấy nguyên tử có đặc điểm:
- Cấu tạo rỗng
- Chứa phần mang điện tích dương, được gọi là hạt nhân
- Kích thước của hạt nhân rất nhỏ so với kích thước của nguyên tử
- Các em chú ý quan sát mô phỏng thí nghiệm tìm ra electron trong đoạn phim sau đây:
Video 1: Thí nghiệm phát hiện ra hạt nhân nguyên tử
- Kết luận:
- Nguyên tử cấu tạo gồm hạt nhân và lớp vỏ nguyên tử (chứa các electron).
- Do nguyên tử trung hòa về điện nên số đơn vị điện tích dương của hạt nhân bằng đúng số electron quay xung quanh hạt nhân.
- Khối lượng nguyên tử xấp xỉ khối lượng hạt nhân.
1.1.3. Cấu tạo của hạt nhân nguyên tử
a. Sự tìm ra hạt proton.
- Năm 1918, hạt proton được tìm ra có:
- Khối lượng: mp = 1,6726.10-27 kg
- Điện tích: qp = + 1,6.10-19 C = e0
- Hạt proton là một thành phần cấu tạo của hạt nhân nguyên tử. Quy ước: 1+
b) Sự tìm ra hạt nơtron
- Năm 1932, Chadwick tìm ra hạt nơtron có:
- Khối lượng: mn \(\approx\) mp = 1,6748.10-27 kg
- Điện tích: qn = 0
- Hạt notron là một thành phần cấu tạo của hạt nhân nguyên tử.
1.2. Kích thước và khối lượng nguyên tử
1.2.1. Kích thước
- Để biểu thị kích thước nguyên tử người ta dùng đơn vị nanomet(nm) hay angstrom Å
-
1 nm = 10-9m ; 1 Å = 10-10m ; 1nm = 10Å
- Nguyên tử nhỏ nhất là nguyên tử Hidro có bán kính khoảng 0,053 nm
- Đường kính của hạt nhân nguyên tử còn nhỏ hơn (vào khoảng 10-5 nm)
- Đường kính của electron và proton còn nhỏ hơn nhiều ( vào khoảng 10-8 nm)
1.2.2. Khối lượng nguyên tử
- Do khối lượng thật của 1 nguyên tử quá bé, người ta dùng đơn vị khối lượng nguyên tử u (đvC).
- 1 u = 1/12 khối lượng 1 nguyên tử đồng vị cacbon 12 = 1,6605.10-27kg.
- m nguyên tử = mP + mN (Bỏ qua me)

Hình 2: Khối lượng và điện tích của các hạt tạo nên nguyên tử
Bài 1:
Bán kính nguyên tử và khối lượng mol nguyên tử Fe lần lượt là 1,28 Ăngstrong và 56 g/mol .Tính khối lượng riêng của Fe, biết rằng trong tinh thể, các nguyên tử Fe chiếm 74% thể tích, phần còn lại là rỗng.
Hướng dẫn:
Đổi 1,28 Ăngstrong = 1,28.10-8 cm
Khối lượng 1 nguyên tử Fe = m = 56 / (6,02.1023) gam
Thể tích 1 nguyên tử Fe = V = 4/3 . п . (1,28.10-8)3 cm3
⇒ d = m / V = 10,59 gam / cm3
Vì Fe chỉ chiếm 74% thể tích tinh thể nên khối lượng riêng thật sự của Fe = 10,59 . 0,74 = 7,84 gam / cm3
Bài 2:
Nguyên tử Au có bán kính và khối lượng mol nguyên tử lần lượt là 1,44A và 197 g/mol. biết khối lượng riêng của Au là 19,36g /cm3 Hỏi các nguyên tử Au chiếm bao nhiêu phần trăm trong tinh thể?
Hướng dẫn:
Đổi 1,44 Ăngstrong = 1,44.10-8 cm
Khối lượng 1 nguyên tử Au = m = 197 / (6,02.1023) gam
Thể tích 1 nguyên tử Au = V = 4/3 . π . (1,44.10-8)3 cm3
⇒ d = m / V = 26,179 g / cm3
Gọi x phần trăm thể tích nguyên tử Au chiếm chỗ, khối lương riêng của Au = 19,36
⇒ 26,179x = 19,36 = 0,7395 = 73,95%
3. Luyện tập Bài 4 Hóa học 10
Sau bài học cần nắm:
- Thí nghiệm tìm ra electron, hạt nhân, proton, nơtron
- Đặc điểm các loại hạt trong nguyên tử: Điện tích, khối lượng...
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 10 Bài 1 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. electron, proton và nơtron
- B. electron và nơtron
- C. proton và nơtron
- D. electron và proton
-
- A. Nguyên tử được cấu tạo từ các hạt cơ bản là p, n, e.
- B. Nguyên tử có cấu trúc đặc khít, gồm vỏ nguyên tử và hạt nhân nguyên tử.
- C. Hạt nhân nguyên tử cấu tạo bởi các hạt proton và hạt nơtron.
- D. Vỏ nguyên tử được cấu tạo từ các hạt electron.
-
- A. 2.
- B. 3.
- C. 4.
- D. 5.
-
- A. electron
- B. electron và nơtron
- C. Proton và notron
- D. proton và electron
-
- A. 1u
- B. 1,2 u
- C. 0,8 u
- D. 1,4 u
Câu 2- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao Chương 1 Bài 1
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 10 Bài 1.
Bài tập 1.4 trang 4 SBT Hóa học 10
Bài tập 1.1 trang 3 SBT Hóa học 10
Bài tập 1.2 trang 3 SBT Hóa học 10
Bài tập 1.4 trang 4 SBT Hóa học 10
Bài tập 1.5 trang 4 SBT Hóa học 10
Bài tập 1.9 trang 4 SBT Hóa học 10
Bài tập 1.10 trang 4 SBT Hóa học 10
Bài tập 1.11 trang 5 SBT Hóa học 10
Bài tập 1 trang 8 SGK Hóa học 10 nâng cao
Bài tập 2 trang 8 SGK Hóa học 10 nâng cao
Bài tập 3 trang 8 SGK Hóa học 10 nâng cao
Bài tập 4 trang 8 SGK Hóa học 10 nâng cao
4. Hỏi đáp về Bài 1: Thành phần nguyên tử
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Copyright © 2021 HOCTAP247