Hoá học 10 Bài 4: Cấu tạo vỏ nguyên tử
Tóm tắt bài
1.1. Sự chuyển động của các electron trong nguyên tử
1.1.1. Mô hình hành tinh nguyên tử
Trong nguyên tử, các e chuyển động xung quanh hạt nhân theo một quỹ đạo xác định như tròn hay bầu dục giống như quỹ đạo của các hành tinh chuyển động xung quanh mặt trời.
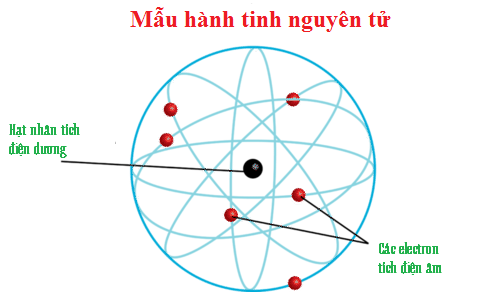
Hình 1: Mô hình mẫu hành tinh nguyên tử
1.1.2. Mô hình hiện đại về sự chuyển động của electron trong nguyên tử, obitan nguyên tử
- Trong nguyên tử các e chuyển động xung quanh hạt nhân không theo quỹ đạo xác định nào.
- Các electron chuyển động trong một khoảng không gian quanh hạt nhân tạo thành vỏ nguyên tử.
Video 1: Sự chuyển động của electron trong nguyên tử
1.2. Lớp electron và phân lớp electron
1.2.1. Lớp electron
- Các electron trên cùng một lớp có mức năng lượng gần bằng nhau.
- Lớp electron được ghi bằng các số nguyên 1, 2, 3, 4... với tên gọi tương ứng K, L, M, N...
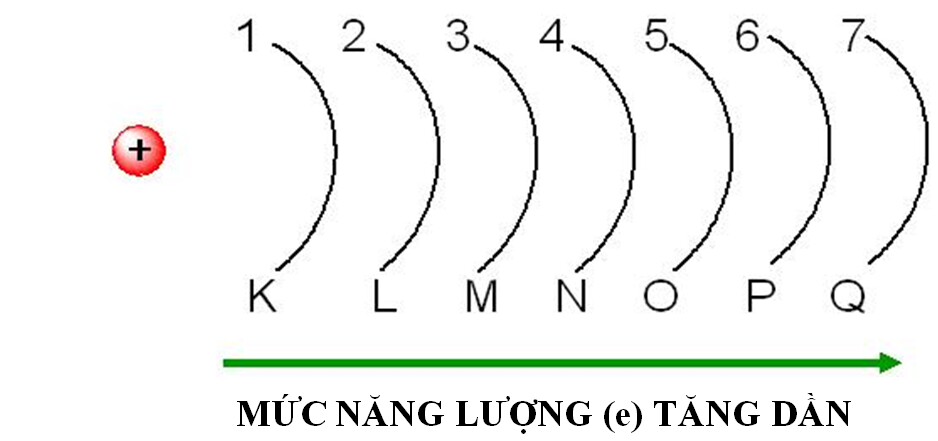
Hình 2: Lớp electron theo thứ tự mức năng lượng tăng dần
1.2.2. Phân lớp electron
- Các electron trên trùng một phân lớp có mức năng lượng gần bằng nhau.
- Các phân lớp được kí hiệu bằng các chữ cái s, p, d, f.
- Ví dụ:
- Lớp K(n=1) có 1 phân lớp: 1s.
- Lớp L(n=2) có 2 phân lớp: 2s, 2p.
- Lớp M(n=3) có 3 phân lớp: 3s, 3p, 3d.
- Lớp N(n=4) có 4 phân lớp: 4s, 4p, 4d, 4f.
1.3. Số electron tối đa trong một phân lớp và trong một lớp
1.3.1. Số electron tối đa trong một phân lớp
|
Phân lớp : |
s |
p |
d |
f |
|
Số e tối đa : |
2 |
6 |
10 |
14 |
|
Kí hiệu : |
s2 |
p6 |
d10 |
f14 |
1.3.2. Số electron tối đa trong một lớp
|
STT lớp (n) |
Số e tối đa (2n2) |
sự phân bố e Vào các phân lớp |
|
n=1(lớp K) |
2 |
1s2 |
|
n=2(lớp L) |
8 |
2s22p6 |
|
n=3(lớp M) |
18 |
3s23p63d10 |
|
n=4( lớp N) |
32 |
4s24p64d104f14 |
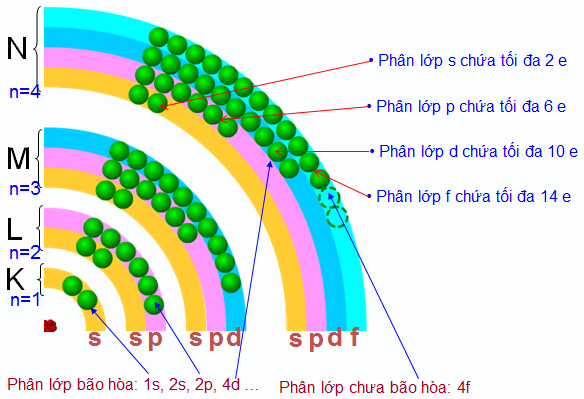
Hình 3: Số electron tối đa trên lớp và phân lớp
1.4. Mô phỏng cách tạo dựng một nguyên tử
Bài 1:
Cho hai đồng vị hiđro với tỉ lệ % số nguyên tử : \({}_1^1H\) (99,984%), \({}_1^2H\) (0,016%) và hai đồng vị của clo : \({}_{17}^{35}Cl\)(75,53%), \({}_{17}^{37}Cl\) (24,47%).
a) Tính nguyên tử khối trung bình của mỗi nguyên tố.
b) Có thể có bao nhiêu loại phân tử HCl khác nhau được tạo nên từ hai loại đồng vị của hai nguyên tố đó.
c) Tính phân tử khối gần đúng của mỗi loại phân tử nói trên.
Hướng dẫn:
a) Nguyên tử khối trung bình của hiđro và clo là:
\(\begin{array}{l} \overline {{A_H}} = \frac{{1.99,984 + 2.0,016}}{{100}} = 1,00016\\ \overline {{A_{Cl}}} = \frac{{35.75,53 + 37.24,47}}{{100}} = 35,5 \end{array}\)
b). Có bốn loại phân tử HCl khác nhau tạo nên từ hai loại đồng vị của hai nguyên tử hiđro và clo.
Công thức phân tử là : \(H{}_{17}^{35}Cl;H{}_{17}^{37}Cl;D{}_{17}^{35}Cl;D{}_{17}^{37}Cl\)
c) Phân tử khối lần lượt: 36 38 37 39
Bài 2:
Vỏ electron của một nguyên tử có 20 electron . Hỏi
a, Nguyên tử đó có bao nhiêu lớp electron ?
b, Lớp ngoài cùng có bao nhiêu electron ?
c, Đó là kim loại hay phi kim ?
Hướng dẫn:
a. Nguyên tử đó có 3 lớp electron
b. Lớp ngoài cùng có 2 electron
c. Đó là kim loại
3. Luyện tập Bài 4 Hóa học 10
Sau bài học cần nắm:
- Sự chuyển động của electron trong nguyên tử?
- Cấu tạo vỏ nguyên tử ra sao? Thế nào là lớp? Phân lớp electron? Mỗi lớp và phân lớp có tối đa bao nhiêu electron?
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 10 Bài 4 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. Hình tròn
- B. Hình bầu dục
- C. hỗn loạn, không theo quxy đạo xác định
- D. hình ziczac
-
- A. 7.
- B. 4.
- C. 3.
- D. 5.
-
- A. 32.
- B. 16.
- C. 8.
- D. 50.
-
- A. 2.
- B. 10.
- C. 6.
- D. 14.
Câu 2- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao Chương 1 Bài 4
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 10 Bài 4.
Bài tập 4.9 trang 10 SBT Hóa học 10
Bài tập 4.10 trang 10 SBT Hóa học 10
Bài tập 4.11 trang 10 SBT Hóa học 10
Bài tập 4.12 trang 11 SBT Hóa học 10
Bài tập 4.13 trang 11 SBT Hóa học 10
Bài tập 4.14 trang 11 SBT Hóa học 10
Bài tập 4.15 trang 11 SBT Hóa học 10
Bài tập 1 trang 25 SGK Hóa học 10 nâng cao
Bài tập 2 trang 25 SGK Hóa học 10 nâng cao
Bài tập 3 trang 25 SGK Hóa học 10 nâng cao
Bài tập 4 trang 25 SGK Hóa học 10 nâng cao
Bài tập 5 trang 25 SGK Hóa học 10 nâng cao
4. Hỏi đáp về Bài 4: Cấu tạo vỏ nguyên tử
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Copyright © 2021 HOCTAP247
