Hoá học 10 Bài 7: Bảng tuần hoàn các nguyên tố hóa học
Tóm tắt bài
1.1. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn
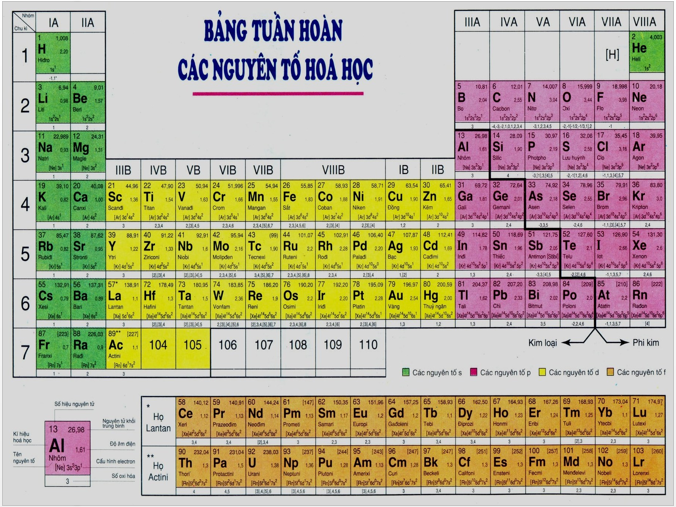
Hình 1: Bảng tuần hoàn các nguyên tố hóa học
- Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
- Các nguyên tố có cùng số lớp electron trong nguyên tử được sắp xếp thành một hàng.
- Các nguyên tố có số electron hóa trị trong nguyên tử như nhau được xếp thành một cột.
1.2. Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
1.2.1. Ô nguyên tố
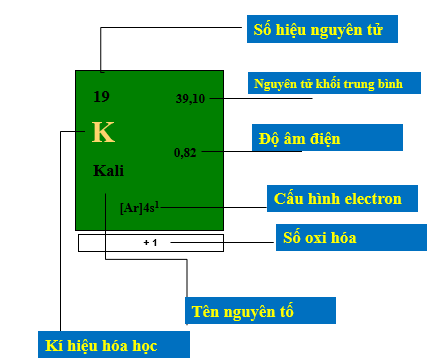
Hình 2: Ô nguyên tố
-
Số thứ tự nguyên tố = số đơn vị điện tích hạt nhân (Z) = số proton = số electron trong nguyên tử.
1.2.2. Chu kì
- Chu kì là dãy các nguyên tố của chúng có cùng số lớp electron, được xếp theo chiều điện tích hạt nhân tăng dần
- Số thứ tự của chu kì bằng số lớp electron trong nguyên tử.
- Bảng tuần hoàn gồm có 7 chu kì
| STT | Nguyên tố bắt đầu | Nguyên tố kết thúc | Số nguyên tố |
| 1. | H (Z = 1): 1s1 | He (Z = 2): 1s2 | 2 |
| 2. | Li (Z = 3) | Ne (Z = 10) | 8 |
| 3. | Na (Z = 11) | Ar (Z = 18) | 8 |
| 4. | K (Z = 19) | Kr (Z = 36) | 18 |
| 5. |
Rb (Z =37) |
Xe (Z = 54) |
18 |
| 6. | Cs (Z = 55) | Rn (Z = 86) | 32 |
| 7. | Fr (Z = 87) | Chưa xác định | Chưa hoàn thiện |
1.3. Nhóm nguyên tố
Nhóm nguyên tố là gồm các nguyên tố có cấu hình electron lớp ngoài cùng tương tự nhau, nên tính chất hóa học gần giống nhau được xếp thành một cột.
Nhóm nguyên tố
- Nhóm A: nsanpb .Với a, b là số electron trên phân lớp s và p. Số thứ tự của nhóm bằng tổng số electron lớp ngoài cùng: a + b
1 ≤ a ≤ 2 ; 0 ≤ b ≤ 6
- Nhóm B:
(n – 1)dansb
Với b = 2 ,0 ≤ a ≤ 10 Các nguyên tố nhóm B là tập hợp các nguyên tố có electron hóa trị nằm trên phân lớp d và f.
Bài 1:
Nguyên tố X thuộc chu kì 3, nhóm IIIA trong bảng HTTH. Vậy X có số hiệu nguyên tử là:
Hướng dẫn:
Chu kỳ 3 ⇒ có 3 lớp e
Nhóm IIIA ⇒ 3 e lớp ngoài cùng và e cuối điền vào phân lớp p
⇒ 1s22s22p63s23p1
⇒ p = 13
Bài 2:
A, B, C là các kim loại chuyển tiếp và đều thuộc chu kỳ 4 trong bảng tuần hoàn (ZA < ZB < ZC). Biết rằng tổng số electron lớp ngoài cùng của A, B và C bằng 4; tổng số electron ở lớp ngoài cùng và phân lớp sát ngoài cùng của B là 8. Điều khẳng định nào sau đây về A, B, C là đúng?
A. Tổng số electron của B2+ và C2+ là 51.
B. Công thức oxit cao nhất của A có dạng A2O3.
C. Tổng số khối: MA + MB + MC = 79.
D. Cả A, B, C đều tác dụng được với dung dịch H2SO4 loãng làm giải phóng khí H2.
Hướng dẫn:
Cấu hình electron của A, B, C có dạng: \([Ar]3d^a4s^a4p^b\)
Do tổng số electron lớp ngoài cùng của A, B, C = 4 nên phải có hai nguyên tố có cấu hình electron lớp ngoài cùng dạng 4s1 và một nguyên tố còn lại 4s2
Vì B có tổng số electron ở lớp ngoài cùng và phân lớp sát ngoài cùng là 8 nên B có cấu hình: \([Ar]3d^64s^ 2\)
Vậy A là: \([Ar]3d^54s^ 1\) và C là: \([Ar]3d^104s^ 1 \rightarrow A: \ _{24}Cr; \ B: \ _{26}Fe; \ C: \ _{29}Cu\)
Đáp án A
3. Luyện tập Bài 7 Hóa học 10
Sau bài học cần nắm:
- Cấu tạo bảng tuần hoàn: ô lượng tử, chu kì, nhóm nguyên tố.
- Nguyên tắc sắp xếp các nguyên tố hóa học trong bảng tuần hoàn.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 10 Bài 7 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. Khối lượng nguyên tử
- B. Số khối
- C. Điện tích hạt nhân
- D. Tất cả đều sai
-
- A. Số khối
- B. Khối lượng nguyên tử
- C. Số hiệu nguyên tử
- D. Tất cả đều đúng
-
- A. Số electron lớp ngoài cùng
- B. Khối lượng nguyên tử
- C. Điện tích hạt nhân
- D. Số lớp electron
-
- A. C, A và B
- B. D, F và C
- C. B, D và E
- D. F, C và E
-
- A. 3.
- B. 5.
- C. 6.
- D. 7.
-
- A. 3 và 3
- B. 3 và 4
- C. 4 và 4
- D. 4 và 3
-
- A. 8 và 18
- B. 18 và 8
- C. 8 và 8
- D. 18 và 18
Câu 3- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 10 Bài 7.
Bài tập 7.8 trang 18 SBT Hóa học 10
Bài tập 7.9 trang 18 SBT Hóa học 10
Bài tập 7.10 trang 18 SBT Hóa học 10
Bài tập 7.11 trang 18 SBT Hóa học 10
Bài tập 1 trang 39 SGK Hóa học 10 nâng cao
Bài tập 2 trang 39 SGK Hóa học 10 nâng cao
Bài tập 3 trang 39 SGK Hóa học 10 nâng cao
Bài tập 4 trang 39 SGK Hóa học 10 nâng cao
Bài tập 5 trang 39 SGK Hóa học 10 nâng cao
Bài tập 6 trang 39 SGK Hóa học 10 nâng cao
Bài tập 7 trang 39 SGK Hóa học 10 nâng cao
Bài tập 8 trang 39 SGK Hóa học 10 nâng cao
4. Hỏi đáp về Bài 7 Chương 2 Hóa học 10
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Copyright © 2021 HOCTAP247