Hoá học 10 Bài 10: Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Tóm tắt bài
1.1. Quan hệ giữa vị trí và cấu tạo
- Vị trí của một nguyên tố trong bảng tuần hoàn, có thể suy ra:
- Số đơn vị điện tích hạt nhân
- Số lớp electron
- Số electron ở lớp ngoài cùng
- Cấu tạo nguyên tử:
- Số proton, số electron
- Số lớp electron
-
Số electron lớp ngoài cùng
1.2. Quan hệ giữa vị trí và tính chất của nguyên tố
Vị trí của một nguyên tố trong bảng tuần hoàn có thể suy ra tính chất hóa học:
- Tính kim loại và phi kim
- Hóa trị cao nhất của nguyên tố đó với oxi, với hiđro (nếu có)
- Oxit, hiđroxit có tính axit hay bazơ.
1.3. So sánh tính chất hóa học của một nguyên tố với các nguyên tố lân cận
-
Trong chu kì theo chiều tăng của Z:
- Tính phi kim tăng dần, tính kim loại yếu dần
- Oxit và hiđroxit của các nguyên tố có tính bazơ yếu dần đồng thời tính axit tăng dần.
-
Trong nhóm A theo chiều tăng dần của Z:
- Tính kim loại tăng dần, tính phi kim giảm dần.
- Oxit và hiđroxit của các nguyên tố có tính bazơ tăng dần, tính axit giảm dần.
1.4. Tổng kết
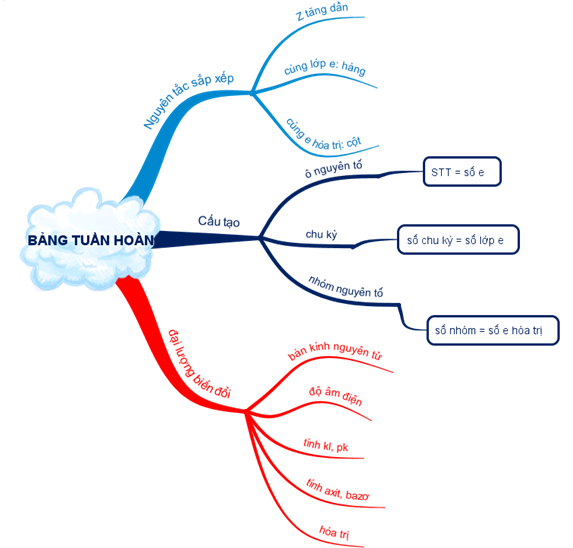
Hình 1: Sơ đồ tư duy về Bảng tuần hoàn
Bài 1:
Mức năng lượng cao nhất trong cấu hình electron của ion kim loại R3+ là 3d3. Vị trí của nguyên tố R trong bảng hệ thống tuần hoàn là:
Hướng dẫn:
Mức năng lượng cao nhất trong cấu hình electron của ion kim loại R3+ là 3d3.
⇒ cấu hình em phân lớp ngoài cùng là 3d3
⇒ Với R thì: 3d54s1 là các phân lớp ngoài cùng
⇒ Chu kỳ IV nhóm VIB
Bài 2:
Cho các nguyên tố: Al (Z = 13), Si (Z = 14), Mg (Z = 12). Dãy các nguyên tố được sắp xếp theo chiều giảm dần bán kính nguyên tử từ trái sang phải là:
Hướng dẫn:
Al: 1s22s22p63s23p1 (nhóm IIIA, chu kỳ 3)
Si: 1s22s22p63s23p2 (nhóm IVA, chu kỳ 3)
Mg: 1s22s22p63s2 (nhóm IIA, chu kỳ 3)
Cùng chu kỳ, đi từ trái sang phải, bán kính nguyên tử giảm dần: Mg, Al, Si.
Bài 3:
Hợp chất A được tạo thành từ ion M+ và ion X2-. Tổng số 3 loại hạt trong A là 140. Tổng số các hạt mang điện trong ion M+ lớn hơn tổng số hạt mang điện trong ion X2- là 19. Trong nguyên tử M, số hạt proton ít hơn số hạt nơtron 1 hạt; trong nguyên tử X, số hạt proton bằng số hạt nơtron. Số p trong M và X lần lượt là:
Hướng dẫn:
A là M2X: 2.(2pM + nM) + (2pX + nX) = 140 (1)
Số hạt mang điện trong M+ = 2pM – 1
Số hạt mang điện trong X2- = 2pX + 2
⇒ 2pM – 1 = (2pX + 2) + 19 ⇒ pM – pX = 11 (2)
Trong M: pM + 1 = nM (3)
Trong X: pX = nX (4)
Giải hệ (1, 2, 3, 4) ta được: pM = 19 và pX = 8
Bài 4:
Hai nguyên tố X, Y thuộc 2 nhóm A liên tiếp. Tổng số proton trong 2 hạt nhân X, Y bằng 23. Nếu X ở nhóm VA thì Y là nguyên tố nào, biết X, Y không phản ứng với nhau:
Hướng dẫn:
X và Y thuộc 2 nhóm A liên tiếp
Ta có: PX + PY =23
Nếu X và Y cùng chu kỳ
⇒ PY – PX = 1
⇒ PX = 11 (Na): thuộc nhóm IA
PY = 12 (Mg) : thuộc nhóm IIA
Theo đề X thuộc nhóm VA (loại)
Vậy X và Y ở hai chu kỳ khác nhau
- Nếu X là N ⇒ PX = 7
Vậy nguyên tố Y sẽ ở nhóm IVA hoặc VIA
- Nếu Y ở nhóm IVA ⇒ PY = 14
PX + PY = 21 (loại)
⇒ Y ở nhóm VIA ⇒ PY =16 (nhận)
X là N; Y là S.
3. Luyện tập Bài 10 Hóa học 10
Sau bài học cần nắm:
- Mối quan hệ giữa vị trí (ô) nguyên tố, cấu tạo nguyên tử và tính chất của nguyên tố ở đơn chất và hợp chất.
- Các kiến thức cơ bản về bảng tuần hoàn và định luật tuần hoàn.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 10 Bài 10 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. Bán kính nguyên tử tăng dần
- B. Tính khử của kim loại giảm dần.
- C. Nhiệt độ nóng chảy giảm dần.
- D. Khối lượng riêng tăng dần.
-
- A. RO3.
- B. R2O7.
- C. R2O3.
- D. R2O.
-
- A. 31.
- B. 14.
- C. 39.
- D. 16.
-
- A. Trong một chu kỳ, từ trái sang phải, bán kính nguyên tử giảm dần.
- B. Trong nhóm A từ trên xuống dưới độ âm điện tăng dần.
- C. Cấu hình e nguyên tử các nguyên tố nhóm A biến đổi tuần hoàn theo chiều tăng dần của điện tích hạt nhân.
- D. Các nguyên tố nhóm B đều là kim loại.
Câu 3- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 10 Bài 10.
Bài tập 10.11 trang 26 SBT Hóa học 10
Bài tập 10.12 trang 26 SBT Hóa học 10
Bài tập 1 trang 57 SGK Hóa học 10 nâng cao
Bài tập 2 trang 58 SGK Hóa học 10 nâng cao
Bài tập 3 trang 58 SGK Hóa học 10 nâng cao
Bài tập 4 trang 58 SGK Hóa học 10 nâng cao
Bài tập 5 trang 58 SGK Hóa học 10 nâng cao
Bài tập 6 trang 58 SGK Hóa học 10 nâng cao
Bài tập 7 trang 58 SGK Hóa học 10 nâng cao
Bài tập 8 trang 58 SGK Hóa học 10 nâng cao
Bài tập 9 trang 58 SGK Hóa học 10 nâng cao
Bài tập 10 trang 58 SGK Hóa học 10 nâng cao
4. Hỏi đáp về Bài 10 Chương 2 Hóa học 10
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Copyright © 2021 HOCTAP247