Hoá học 10 Bài 14: Tinh thể nguyên tử và tinh thể phân tử
Tóm tắt bài
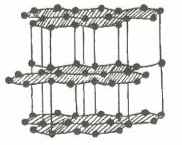
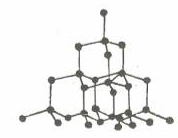
1.1. Tinh thể nguyên tử
1.1.1. Tinh thể nguyên tử
|
Than chì |
Kim cương |
|
| Tính chất vật lí |
|
|
|
Cấu trúc |
|
|
|
Ứng dụng |
Làm điện cực, làm nồi để nấu chảy hợp kim chịu nhiệt, chế tạo chất bôi trơn, bút chì đen ... |
Làm đồ tráng sức, chế tạo mũi khoan,dao cắt thủy tinh, làm bột mài... |
1.1.2. Tính chất chung của tinh thể nguyên tử
- Lực liên kết cộng hóa trị trong tinh thể nguyên tử rất lớn. Vì vậy, tinh thể bền vững, rất cứng, nhiệt độ nóng chảy và nhiệt độ sôi khá cao.
- Kim cương có độ cứng lớn nhất so với các tinh thể đã biết nên quy ước có độ cứng là 10 đơn vị. Đó là đơn vị để so sánh độ cứng của các chất.
1.2. Tinh thể phân tử
1.2.1. Tinh thể phân tử
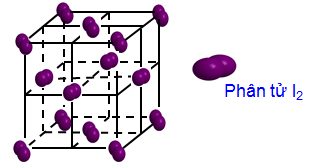
Hình 1: Cấu trúc phân tử Iod
-
Tại nút mạng tinh thể là các phân tử I2.
-
Các phân tử I2 trong tinh thể hút nhau bằng lực tương tác yếu.
-
Tinh thể iot (I2) là tinh thể phân tử, ở nhiệt độ thường iot ở thể rắn với cấu trúc tinh thể mạng lưới lập phương tâm diện: các phân tử iot ở 8 đỉnh và ở các tâm 6 mặt của hình lập phương.
1.2.2. Tính chất chung của tinh thể phân tử
- Trong tinh thể phân tử, các phân tử vẫn vốn tồn tại như những đơn vị độc lập và hút nhau bằng lực tương tác yếu giữa các phân tử. Vì vậy, tinh thể phân tử dễ nóng chảy, dễ bay hơi.
- Các tinh thể phân tử không phân cực dễ hòa tan trong các dung môi không phân cực như Benzen, toluen, cacbon tetraclorua...
Bài 1:
Hãy lập bảng so sánh tinh thể ion, tinh thể nguyên tử và tinh thể phân tử theo mẫu sau?
| Ion | Nguyên tử | Phân tử | |
| Ví dụ | |||
| Nút mạng | |||
| Lực liên kết | |||
| Tính chất chung |
Hướng dẫn:
| Ion | Nguyên tử | Phân tử | |
| Ví dụ |
Muối ăn… |
Kim cương, than chì, thiếc… |
Iot, nước đá, băng phiến(long não)… |
| Nút mạng |
Các ion âm và ion dương |
Nguyên tử |
Phân tử |
| Lực liên kết |
Lực hút tĩnh điện lớn |
Lực liên kết cộng hoá trị lớn |
Lực tương tác yếu giữa các phân tử |
| Tính chất chung |
Bền vững; to nóng chảy , to sôi cao |
Cứng; to nóng chảy , to sôi cao |
Mềm; to nóng chảy , to sôi thấp |
3. Luyện tập Bài 14 Hóa học 10
Sau bài học cần nắm:
- Tinh thể nguyên tử? Tinh thể phân tử?
- Tính chất chung của tinh thể nguyên tử, tinh thể phân tử.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 10 Bài 14 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. Kim cương là một dạng thù hình của cacbon, thuộc loại tinh thể nguyên tử.
- B. Trong tinh thể nguyên tử, các nguyên tử được sắp xếp một các đều đặn theo một trật tự nhất định.
- C. Lực liên kết giữa các nguyên tử trong tinh thể nguyên tử là liên kết yếu.
- D. Tinh thể nguyên tử bền vững, rất cứng, nhiệt độ nóng chảy và nhiệt độ sôi khá cao.
-
- A. H2O và I2
- B. Cu và Fe
- C. Kim cương và Silic
- D. NaCl và Ca(NO3)2
-
- A. Bo và Kim cương
- B. CO2 và Kim cương
- C. CO2 và Naphtalen
- D. NaCl và KNO3
Câu 3- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 10 Bài 14.
Bài tập 6 trang 71 SGK Hóa học 10
Bài tập 14.1 trang 35 SBT Hóa học 10
Bài tập 14.2 trang 35 SBT Hóa học 10
Bài tập 14.3 trang 35 SBT Hóa học 10
Bài tập 14.4 trang 35 SBT Hóa học 10
Bài tập 14.5 trang 35 SBT Hóa học 10
Bài tập 1 trang 85 SGK Hóa học 10 nâng cao
Bài tập 2 trang 85 SGK Hóa học 10 nâng cao
Bài tập 3 trang 85 SGK Hóa học 10 nâng cao
Bài tập 4 trang 85 SGK Hóa học 10 nâng cao
Bài tập 5 trang 85 SGK Hóa học 10 nâng cao
Bài tập 6 trang 85 SGK Hóa học 10 nâng cao
4. Hỏi đáp về Bài 14 Chương 3 Hóa học 10
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Copyright © 2021 HOCTAP247