Hoá học 10 Bài 16: Luyện tập Liên kết hóa học
Tóm tắt bài
1.1. So sánh liên kết ion và liên kết cộng hóa trị
| Loại liên kết |
Liên kết ion |
Liên kết cộng hoá trị |
|
|
Không cực |
Có cực | ||
|
Định nghĩa |
Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu. |
Liên kết cộng hoá trị là liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung. |
|
|
Bản chất của liên kết |
Cho và nhận electron |
Đôi electron chung không lệch về nguyên tử nào. |
Đôi e chung lệch về nguyên tử nào có độ âm điện lớn hơn. |
| Hiệu độ âm điện |
≥ 1,7 |
0 → 0,4 |
0,4 → |
1.2. So sánh tinh thể ion, tinh thể nguyên tử, tinh thể phân tử
| Tinh thể ion | Tinh thể nguyên tử | Tinh thể phân tử | |
| Khái niệm | Các cation và anion được phân bố luân phiên đều đặn ở các điểm nút của mạng tinh thể ion | Ở các điểm nút mạng tinh thể nguyên tử là những nguyên tử | Ở các điểm nút của mạng tinh thể phân tử là các phân tử |
| Lực liên kết | Các ion mang điện tích trái dấu hút nhau bằng lực hút tĩnh điện, lực này lớn. | Các nguyên tử liên kết với nhau bằng lực liên kết cộng hóa trị. Lực này rất lớn. | Các phân tử liên kết với nhau bằng lực hút giữa các phân tử, yếu hơn nhiều lực hút tĩnh điện giữa các ion và lực liên kết cộng hóa trị |
| Đặc tính | Bền, khá rắn, khó bay hơi, khó nóng chảy | Bền, khá cứng, khó nóng chảy, khó bay hơi | Không bền, dễ nóng chảy, dễ bay hơi |
Bài 1:
Dựa vào giá trị hiệu độ âm điện của 2 nguyên tử, hãy xác định loại liên kết trong các phân tử sau:
|
Phân tử |
Hiệu độ âm điện |
Loại liên kết |
|
H2S |
||
|
NH3 |
||
|
CaS |
||
|
H2O |
||
|
BaF2 |
||
|
Cl2 |
Cho biết giá trị độ âm điện của các nguyên tố như sau:
| Ca | Ba | H | S | N | Cl | O | F |
| 1,0 | 0,89 | 2,2 | 2,58 | 3,04 | 3,16 | 3,44 | 3,98 |
Hướng dẫn:
|
Phân tử |
Hiệu độ âm điện |
Loại liên kết |
|
H2S |
2,58 – 2,2 = 0,38 |
Liên kết cộng hóa trị không cực |
|
NH3 |
3,04 - 2,2 = 0,84 > 0,4 |
Liên kết cộng hóa trị có cực |
|
CaS |
2,58 – 1,0 = 1,58 >0,4 |
Liên kết cộng hóa trị có cực |
|
H2O |
3,44 – 2,2 = 1,24 >0,4 |
Liên kết cộng hóa trị có cực |
|
BaF2 |
3,98 –0,89 =3,09 >1,7 |
Liên kết ion |
|
Cl2 |
0 |
Liên kết cộng hóa trị không cực |
Bài 2:
Xác định số oxi hóa của nguyên tố trung tâm trong các hợp chất sau: HNO3, H2S, NaNO3, K2SO4, KMnO4, K2Cr2O7
Hướng dẫn:
HNO3: N có số oxi hóa là +5
H2S: S có số oxi hóa là -2
NaNO3: N có số oxi hóa là +5
K2SO4: S có số oxi hóa là +6
KMnO4: Mn có số oxi hóa là +7
K2Cr2O7: Cr có số oxi hóa là +6
3. Luyện tập Bài 16 Hóa học 10
Sau bài học cần nắm:
- Kiến thức về các loại liên kết hóa học chính để vận dụng, giải thích sự hình thành một số loại phân tử.
- Đặc điểm cấu trúc và đặc điểm liên kết của ba loại tinh thể.
- Xác định hóa trị và số oxi hóa của nguyên tố trong đơn chất và hợp chất.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 10 Bài 16 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. -1, +1, +5, +1, +7
- B. -1, +1, +3, +1, +5
- C. -1, -1, +5, +1, +7
- D. -1, +1, +7, +1, +5
-
-
A.
-
B.
-
C.
-
D.
-
A.
-
- A. HCl, NaCl, Cl2
- B. NaCl, Cl2, HCl
- C. Cl2, HCl, NaCl
- D. Cl2, NaCl, HCl
-
- A. ion.
- B. cộng hoá trị phân cực.
- C. cộng hoá trị không phân cực.
- D. phối trí.
-
- A. Cl2, Br2, I2, HCl
- B. Na2O, KCl, BaCl2, Al2O3
- C. HCl, H2S, NaCl, N2O
- D. MgO, H2SO4, H3PO4, HCl
Câu 3- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 10 Bài 16.
Bài tập 16.14 trang 39 SBT Hóa học 10
Bài tập 16.15 trang 39 SBT Hóa học 10
Bài tập 16.16 trang 39 SBT Hóa học 10
Bài tập 16.17 trang 39 SBT Hóa học 10
Bài tập 16.18 trang 39 SBT Hóa học 10
Bài tập 16.19 trang 39 SBT Hóa học 10
Bài tập 16.20 trang 39 SBT Hóa học 10
Bài tập 1 trang 87 SGK Hóa học 10 nâng cao
Bài tập 2 trang 87 SGK Hóa học 10 nâng cao
Bài tập 3 trang 87 SGK Hóa học 10 nâng cao
Bài tập 4 trang 87 SGK Hóa học 10 nâng cao
Bài tập 5 trang 87 SGK Hóa học 10 nâng cao
4. Hỏi đáp về Bài 16 Chương 3 Hóa học 10
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Copyright © 2021 HOCTAP247

.PNG)
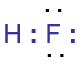

.PNG)