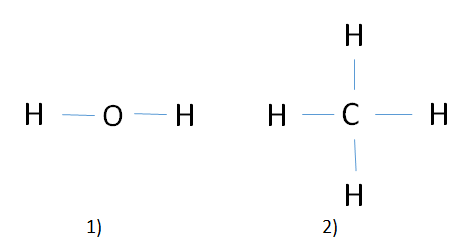Hoá học 10 Bài 15: Hóa trị và số oxi hóa
Tóm tắt bài
1.1. Hóa trị
1.1.1. Hóa trị trong hợp chất ion
- Trong các hợp chất ion , hóa trị của 1 nguyên tố bằng điện tích của ion và được gọi là điện hóa trị của nguyên tố đó.
-
Ví dụ: Trong hợp chất NaCl , Na có điện hóa trị 1+ và Cl có điện hóa trị 1– . Trong hợp chất CaF2, Ca có điện hóa trị 2+ và F có điện hóa trị 1–
- Người ta quy ước , khi viết điện hóa trị của nguyên tố , ghi giá trị điện tích trước, dấu của điện tích sau
- Các nguyên tố kim loại thuộc nhóm IA , IIA , IIIA có số electron ở lớp ngoài cùng là 1, 2, 3 có thể nhường nên có điện hóa trị là 1+ , 2+ , 3+
- Các nguyên tố phi kim thuộc nhóm VIA , VIIA nên có 6, 7 electron lớp ngoài cùng , có thể nhận thêm 2 hay 1 electron vào lớp ngoài cùng , nên có điện hóa trị 2– , 1–
1.1.2. Hóa trị trong hợp chất cộng hóa trị
- Quy tắc : Trong các hợp chất cộng hóa trị, hóa trị của 1 nguyên tố được xác định bằng số liên kết cộng hóa trị của nguyên tử nguyên tố đó trong phân tử và được gọi là cộng hóa trị của nguyên tố đó.
-
Ví dụ: Hoá trị các nguyên tố trong phân tử nước và metan
Hình 1: 1) Phân tử nước - 2) Phân tử Metan
⇒ Trong H2O : Nguyên tố H có cộng hóa trị 1 , nguyên tố O có cộng hóa trị 2
⇒ Trong CH4 : Nguyên tố C có cộng hóa trị hóa trị 4 , nguyên tố H có cộng hóa trị 1
1.2. Số oxi hóa
1.2.1. Khái niệm
Số oxi hóa của 1 nguyên tố trong phân tử là điện tích của nguyên tử nguyên tố đó trong phân tử , nếu giả định rằng mọi liên kết trong phân tử đều là liên kết ion.
1.2.2. Các quy tắc xác định số oxi hóa
- Quy tắc 1: Số oxi hóa của các nguyên tố trong các đơn chất bằng không
- Quy tắc 2: Trong 1 phân tử, tổng số số oxi hóa của các nguyên tố bằng 0
- Quy tắc 3: Số oxi hóa của các ion đơn nguyên tử bằng điện tích của ion đó . Trong ion đa nguyên tử , tổng số số oxi hóa của các nguyên tố bằng điện tích của ion
- Quy tắc 4: Trong hầu hết các hợp chất, số oxi hóa của H bằng +1 , trừ 1 số trường hợp như hidro, kim loại (NaH , CaH2 ….) . Số oxi hóa của O bằng –2 trừ trường hợp OF2 , peoxit (chẳng hạn H2O2 , …)
1.2.3. Ví dụ
Thí dụ: Trong phân tử đơn chất Fe, Zn, H2, O2 thì số oxi hóa của các nguyên tố đều bằng không
Thí dụ: Trong SO2 , số oxi hóa của O là -2 → Số oxi hóa của S là +4
Trong H2S, số oxi hóa của H là +1 → Số oxi hóa của S là -2
Trong H2SO4, số oxi hóa của O là -2, số oxi hóa của H là +1 → Số oxi hóa của S là +6
Thí dụ: Số oxi hóa của các nguyên tố ở các ion K+ , Ca2+ , Cl– S2– lần lượt là +1 , +2 , –1 , –2
Thí dụ:
Số oxi hóa của N trong ion NH4+ là x
x.1 + 4(+1) = +1 ⇒ x = -3
Số oxi hóa của N trong ion NO3– là x
x + 3(–2) = –1 ⇒ x =+5
Bài 1:
Xác định số oxi hóa của các nguyên tố trong các hợp chất, đơn chất và ion sau:
a) H2S, S, K2SO4 , NH4+
b) HCl, HClO, MnO4-, Zn
c) Mn, MnCl2 , MnO2 , PO43-
d) KMnO4 , Fe , H2SO3 , SO42-
Hướng dẫn:
Trong hợp chất H có số oxi hóa là +1, O có số oxi hóa là -2) chỉ trừ trường hợp NaH và H2O2 (Hidro peoxit hay oxi già)
a) H2S (H có số oxi hóa là +1, S có số oxi hóa là -2)
S (đơn chất nên số oxi hóa bằng 0)
K2SO4 (K có số oxi hóa +1, S có số oxi hóa +6, O có số oxi hóa -2)
NH4+ (N có số oxi hóa là -3, H có số oxi hóa là +1)
b) HCl (Cl có số oxi hóa là -1)
HClO (Cl có số oxi hóa là +1)
MnO4- (Mn có số oxi hóa là +7)
Zn (Zn có số oxi hóa là 0)
c) Mn (Mn có số oxi hóa là 0)
MnCl2 (Mn có số oxi hóa là +2, Cl có số oxi hóa là -1)
MnO2 (Mn có số oxi hóa là +4, O có số oxi hóa là -2)
PO43- (P có số oxi hóa là +5, O có số oxi hóa là -2)
d) KMnO4 (K có số oxi hóa là +1, Mn có số oxi hóa là +7, O có số oxi hóa là -2)
Fe (Fe có số oxi hóa là 0)
H2SO3 (H có oxi hóa là +1, S có số oxi hóa là +4, O có số oxi hóa là -2)
SO42- (S có số oxi hóa là +6, O có số oxi hóa là -2)
Bài 2:
a) Xác định cộng hóa trị và số oxi hóa của các chất sau đây: N2, Cl2, H2O
b) Xác định điện hóa trị và số oxi hóa của các chất sau: NaCl, AlCl3
Hướng dẫn:
|
Công thức |
Cộng hóa trị |
Số oxi hóa |
|
\(N \equiv N\) |
N là 3 |
N là 0 |
|
Cl – Cl |
Cl là 1 |
Cl là 0 |
|
H – O – H |
H là 1 O là 2 |
H là +1 O là -2 |
|
Công thức |
Điện hóa trị |
Số oxi hóa |
|
NaCl |
Na là 1+ Cl là 1- |
Na là +1 Cl là -1 |
|
AlCl3 |
Al là 3+ Cl là 1- |
Al là +3 Cl là -1 |
3. Luyện tập Bài 15 Hóa học 10
Sau bài học cần nắm:
- Điện hoá trị, hóa trị của nguyên tố trong hợp chất ion, trong hợp chất cộng hóa trị
- Số oxi hoá của nguyên tố trong các phân tử đơn chất và hợp chất.
- Những quy tắc xác định số oxi hoá của nguyên tố.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 10 Bài 15 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. +1
- B. 1
- C. 1+
- D. 1-
-
- A. +7
- B. +6
- C. 7+
- D. 6+
-
- A. +3
- B. +2
- C. +5
- D. +4
-
- A. N2 > NO3- > NO2 > N2O > NH4+
- B. NO3- > N2O > NO2 > N2 > NH4+
- C. NO3- > NO2 > N2O > N2 > NH4+
- D. NO3- > NO2 > NH4+ > N2 > N2O
Câu 3- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 10 Bài 15.
Bài tập 15.11 trang 37 SBT Hóa học 10
Bài tập 15.12 trang 37 SBT Hóa học 10
Bài tập 15.13 trang 37 SBT Hóa học 10
Bài tập 15.15 trang 37 SBT Hóa học 10
Bài tập 15.14 trang 37 SBT Hóa học 10
Bài tập 15.16 trang 37 SBT Hóa học 10
Bài tập 1 trang 90 SGK Hóa học 10 nâng cao
Bài tập 2 trang 90 SGK Hóa học 10 nâng cao
Bài tập 3 trang 90 SGK Hóa học 10 nâng cao
Bài tập 4 trang 90 SGK Hóa học 10 nâng cao
Bài tập 5 trang 90 SGK Hóa học 10 nâng cao
Bài tập 6 trang 90 SGK Hóa học 10 nâng cao
4. Hỏi đáp về Bài 15 Chương 3 Hóa học 10
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Copyright © 2021 HOCTAP247