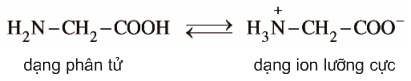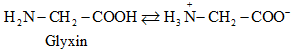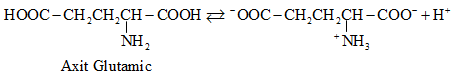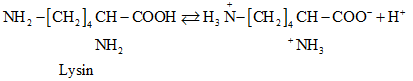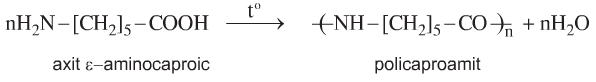Hoá học 12 Bài 10: Amino axit
Tóm tắt bài
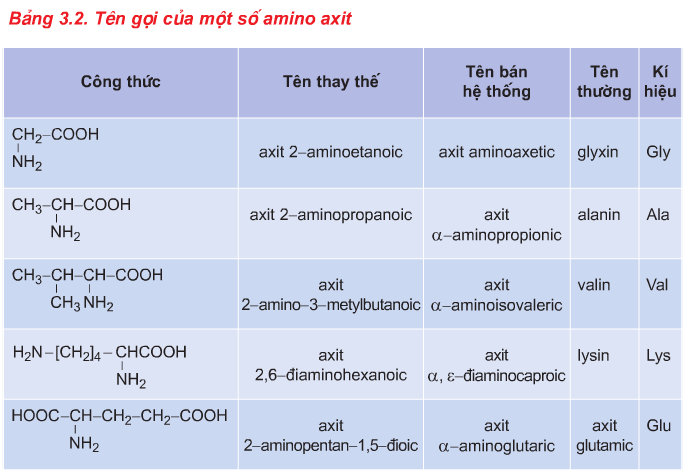
2.1. Khái niệm và Danh pháp
a. Khái niệm
- Thành phần phân tử: C, H, O, N.
- Công thức chung (NH2)xR(COOH)y với \(x, y\geq 1\)
- Khái niệm: Amino axit là loại hợp chất hữu cơ tạp chức mà phân tử chứa đồng thời nhóm amino (NH2) và nhóm cacboxyl (COOH). Ví dụ:
b. Danh pháp
Axit+ số thứ tự C gắn với NH2 + amino + tên gốc axit tương ứng.
2.2. Cấu tạo phân tử
-
Ở trạng thái kết tinh aa tồn tại ở dạng ion lưỡng cực.
-
Trong dd dạng ion chuyển một phần nhỏ thành dạng phân tử.
2.3. Tính chất hóa học
a. Tính chất lưỡng tính
Amino axit tác dụng với dd axit vô cơ mạnh và dd bazơ mạnh
H2NCH2COOH+HCl → ClH3NCH2COOH
H3NCH2COOH + HCl → ClNCH2COOH
H2NCH2COOH+NaOH → H2NCH2COONa
b. Tính axit - bazơ của dung dịch amino axit
Amino axit (NH2)xR(COOH)y
- Khi x = y, pHdd \(\approx\) 7
- Khi x dd
- Khi x > y, pHdd > 7
c. Phản ứng riêng của COOH: Phản ứng este hóa
d. Phản ứng trùng ngưng
2.4. Ứng dụng
- Là những hợp chất cơ sở để kiến tạo nên các loại protein trong cơ thể sống.
- Muối Mononatri của Axit Glutamic dùng làm bột ngọt, axit glutamic là thuốc bổ trợ thần kinh, methionin là thuốc bổ gan.
- Là nguyên liệu để sản xuất nilon 6, nilon 7, ...
3.1. Bài tập Amino axit - Cơ bản
Bài 1:
Cho các dung dịch riêng biệt chứa các chất: anilin (1), metylamin (2), glixin (3), axit glutamic (4), axit 2,6- điamino hexanoic (5), H2NCH2COONa (6). Các dung dịch làm quỳ tím hóa xanh là
Hướng dẫn:
Các amino axit có số nhóm -NH2 nhiều hơn -COOH làm quỳ tím hóa xanh. Vậy các dung dịch làm quỳ hóa xanh là (2), (5), (6)
(5)
\(C-C-C-C-C-COOH\)
\(\mid\) \(\mid\)
\(NH_{2}\) \(NH_{2}\)
( Lysin)
(6)
\(H_{2}N-CH_{2}-COONa\)
Bài 2:
Cho 8,24 gam α-amino axit X (phân tử có một nhóm –COOH và một nhóm –NH2) phản ứng với dung dịch HCl dư thì thu được 11,16 gam muối. X là
Hướng dẫn:
X có dạng: H2NRCOOH + HCl → ClH3NRCOOH
⇒ Bảo toàn khối lượng: mX + mHCl = mMuối ⇒ nHCl = 0,08 mol
⇒ MX = 103 = R + 61 ⇒ R = 42 (C3H6)
Vì là α-amino axit ⇒ Chất thỏa mãn: H2NCH(C2H5)COOH
Bài 3:
Cho 200 ml dung dịch amino axit X nồng độ 0,2M tác dụng vừa đủ với 80 ml dung dịch NaOH 0,5M, thu được dung dịch chứa 5 gam muối. Công thức của X là?
Hướng dẫn:
Ta có nX = 0,04; nNaOH = 0,04 mol.
⇒ Mmuối = 5 : 0,04 = 125.
⇒ Công thức muối NH2C3H6COONa.
⇒ X là H2NC3H6COOH.
3.2. Bài tập Amino axit - Nâng cao
Bài 1:
Cho 13,23 gam axit glutamic phản ứng với 200 ml dung dịch HCl 1M thu được dung dịch X. Cho 400 ml dung dịch NaOH 1M vào X được Y. Cô cạn Y thu được m gam rắn khan, biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
Hướng dẫn:
Axit glutamic có dạng: HOOC – CH2 – CH2 – CH(NH2) – COOH
⇒ naxit glutamic = 0,09 mol
Có nHCl = 0,2 mol; nNaOH = 0,4 mol
⇒ nNaOH dư = nNaOH ban đầu – (2nGlutamic + nHCl) = 0,02 mol
⇒ Chất rắn khan gồm:
0,02 mol NaOH;
0,09 mol NaOOC – CH2 – CH2 – CH(NH2) – COONa;
0,2 mol NaCl.
⇒ m = 29,69 g
Bài 2:
Cho 4,41 gam một amino axit X tác dụng với dung dịch NaOH dư cho ra 5,73 gam muối. Mặt khác cũng lượng X như trên nếu cho tác dụng với dung dịch HCl dư thu được 5,505 g muối clorua. Công thức cấu tạo của X là:
Hướng dẫn:
Cứ 1 gốc -COOH + NaOH 1 gốc -COONa
và 1 gốc -NH2 + HCl 1 gốc -NH3Cl
\(\Rightarrow\) Khi X + NaOH dư:
\(\Rightarrow \Delta m = m _{muoi} - m_X = m_{COONa} - m_{-COOH}\)
\(\Rightarrow n_{-COOH}\times (67 - 45) = 5,73 - 4,41\)
\(\Rightarrow n_{-COOH} = 0,06\ (mol)\)
Khi X + HCl ta có:\(\Delta m = m_{muoi} - m_X = m_{-NH_3Cl} - m_{-NH_2}\)
\(\Rightarrow n_{-NH_2}\times (52,5 - 16) = 5,505 - 4,41\)
\(\Rightarrow n_{-NH_2} = 0,03\ (mol)\)
\(\Rightarrow\) Ta thấy trong 4,41 g X có
\(\left\{\begin{matrix} 0,03 \ mol-NH_2\\ 0,06 \ mol-COOH \end{matrix}\right.\)
\(\Rightarrow\) Đặt CTPT X là: R(COOH)2n(NH2)n \(\Rightarrow\) nX = (mol)
\(\Rightarrow\) MX = R + 90n + 16n
⇔ R = 41n
Ta thấy: n = 1; MR = 41 \(\Rightarrow\) R = C3H5 thỏa mãn
\(\Rightarrow\) X là HOOC-CH2-CH(NH2)-CH2-COOH hoặc HOOC-CH(NH2)-CH2-CH2-COOH
4. Luyện tập Bài 10 Hóa học 12
Sau bài học cần nắm:
- khái niệm, tính chất hóa học điển hình của amino axit
- ứng dụng Amino axit
4.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 12 Bài 10 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. Cacboxyl và hidroxyl
- B. Hidroxyl và amino
- C. Cacboxyl và amino
- D. Cacbonyl và amino
-
- A. Lysin
- B. Glyxin
- C. Alanin
- D. Axit glutamic
-
- A. Axit glutamic là thuốc bổ thần kinh
- B. Muối đinatri glutamat dùng làm gia vị thức ăn (gọi là mì chính hay bột ngọt)
- C. Amino axit thiên nhiên (hầu hết là a-amino axit) là cơ sở để kiến tạo nên các loại protein của cơ thể sống.
- D. Các amino axit có nhóm –NH2 ở vị trí số 6 trở lên là nguyên liệu để sản xuất tơ nilon.
-
- A. Alanin.
- B. Phenylalanin.
- C. Glixin.
- D. Valin.
-
- A. 100 ml.
- B. 150 ml.
- C. 400 ml.
- D. 250 ml.
-
- A. 4
- B. 1
- C. 2
- D. 3
Câu 3- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
4.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 12 Bài 10.
Bài tập 8 trang 67 SGK Hóa 12 Nâng cao
Bài tập 10.1 trang 19 SBT Hóa học 12
Bài tập 10.2 trang 20 SBT Hóa học 12
Bài tập 10.3 trang 20 SBT Hóa học 12
Bài tập 10.4 trang 20 SBT Hóa học 12
Bài tập 10.5 trang 20 SBT Hóa học 12
Bài tập 10.6 trang 20 SBT Hóa học 12
Bài tập 10.7 trang 20 SBT Hóa học 12
Bài tập 10.8 trang 21 SBT Hóa học 12
Bài tập 10.9 trang 21 SBT Hóa học 12
Bài tập 10.10 trang 21 SBT Hóa học 12
Bài tập 3 trang 67 SGK Hóa học 12 nâng cao
5. Hỏi đáp về Bài 10 Chương 3 Hoá học 12
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Copyright © 2021 HOCTAP247