Bài tập 6 trang 143 SGK Hóa học 10
Bài tập 6 trang 143 SGK Hóa học 10
Có 100ml dung dịch H2SO4 98%, khối lượng riêng là 1,84 g/ml. Người ta muốn pha chế loãng thể tích H2SO4 trên thành dung dịch H2SO4 20%:
a) Tính thể tích nước cần dùng để pha loãng?
b) Khi pha loãng phải tiến hành như thế nào?
Câu a:
Cách 1: Dựa vào các công thức tính toán
\(\begin{array}{l} m = D.V\\ C\% = \frac{{{m_{ct}}}}{{{m_{dd}}}}.100\\ {m_{dung{\rm{ }}dich}} = {m_{dung{\rm{ }}moi}} + {m_{chat\tan }} \end{array}\)
Thể tích nước cần dùng để pha loãng.
Khối lượng của 100ml dung dịch axit 98%
100ml × 1,84 g/ml = 184g
Khối lượng H2SO4 nguyên chất trong 100ml dung dịch trên
Khối lượng dung dịch axit 20% có chứa 180,32g H2SO4 nguyên chất.
Khối lượng nước cần bổ sung vào 100ml dung dịch H2SO4 98% để có được dung dịch 20%.
901,6g – 184g = 717,6g
Vì khối lượng riêng của nước là 1 g/ml nên thể tích nước cần bổ sung là 717,6 ml.
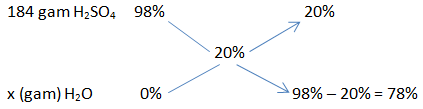
Cách 2: Dựa vào sơ đồ đường chéo
Muốn pha loãng dung dịch, ta sử dụng nước, coi nước là axit có nồng độ là O.
Khối lượng dung dịch axit sunfuric là:
m = D. V = 1,84 . 100 = 184 (g)
Áp dụng sơ đồ đường chéo:
Ta có tỉ lệ:
\(\frac{{184}}{x} = \frac{{20}}{{78}} \Rightarrow x = 717,6(gam)\)
Câu b:
Cách tiến hành khi pha loãng
- Khi pha loãng lấy 717,6 ml H2O vào ống đong hình trụ có thể tích khoảng 2 lít.
- Sau đó cho từ từ 100ml H2SO4 98% vào lượng nước trên, đổ axit chảy theo một đũa thủy tinh, sau khi đổ vài giọt nên dùng đũa thủy tinh khuấy nhẹ đều.
Chú ý: Không được đổ nước vào axit 98%, axit sẽ bắn vào da, mắt ... và gây bỏng rất nặng.
-- Mod Hóa Học 10
Video hướng dẫn giải bài 6 SGK
Copyright © 2021 HOCTAP247