Hoá học 10 Bài 29: Oxi - Ozon
Tóm tắt bài
1.1. OXI
1.1.1. Vị trí và cấu tạo
- Vị trí: ô 8, chu kì 2, nhóm VIA
- Cấu hình electron: 1s22s22p4
- Công thức: O = O
- CTPT: O2
1.1.2. Tính chất vật lí
- Chất khí không màu, không mùi, không vị, nặng hơn không khí (d=1,1), ít tan trong nước
- Oxi hóa lỏng ở - 1830 C. Oxi lỏng có màu xanh da trời
Hình 1: Oxi lỏng có màu xanh da trời
1.1.3. Tính chất hoá học
- \({\rm{ }}\mathop {{O_{2\;}}}\limits^0 + {\rm{ }}2.2e\; \to \;{\rm{ }}\mathop O\limits^{ - 2} \)
⇒ Đa số trong các hợp chất nguyên tố oxi có số oxi hóa -2 (trừ hợp chất với Flo và peoxit).
- \({\chi _{\rm{O}}} = 3,44{\rm{
⇒ Oxi là một phi kim hoạt động, có tính oxi hóa mạnh.
Tác dụng với kim loại (trừ Au, Pt…)
Video 1: Phản ứng giữa Magie với oxi
- Hiện tượng: Magie cháy sáng
- Phương trình phản ứng: 2Mg + O2
2MgO
Video 2: Phản ứng giữa sắt và Oxi
- Hiện tượng: Sắt cháy sáng trong bình chứa Oxi
- Phương trình phản ứng: 3Fe + 2O2
Fe3O4
- Lưu ý: Fe3O4 là hỗn hợp của FeO và Fe2O3
Tác dụng với phi kim (trừ halogen)
- Cacbon cháy trong không khí (nhóm than củi nấu bếp)
C + O2 .PNG)
- Đốt cháy Photpho đỏ trong bình chứa khí Oxi
P + O2 .PNG)
Video 3: Đốt cháy Photpho đỏ trong bình chứa khí Oxi
- Đốt bột lưu huỳnh trong oxi xảy ra hiện tượng lưu huỳnh cháy với ngọn lửa màu xanh.
S + O2 .PNG)
Video 4: Lưu huỳnh cháy trong oxi
Tác dụng với hợp chất
- CO cháy trong không khí: CO + O2
CO2
(CO là sản phẩm do C cháy không hoàn toàn trong không khí. CO tiếp tục cháy để tạo CO2)
Lưu ý: Phụ nữ sau sinh con có tập tục nằm than. Điều này không tốt cho sức khỏe. Than khi đốt cháy sinh ra khí CO2. Đây là khí độc không tốt cho mẹ, đặc biệt là con nhỏ. Hệ hô hấp của bé còn yếu mà lại được đặt trong căn phòng “ngập tràn” CO2 khiến bé hít thở khó khăn, có trường hợp dẫn tới ngạt thở tử vong. CO2 cũng khiến cho bé mắc các bệnh về phổi sau này.
-
Rượu etylic cháy khi phản ứng với oxi
C2H5OH + 3O2 .PNG)
Video 5: Rượu etylic cháy khi phản ứng với oxi
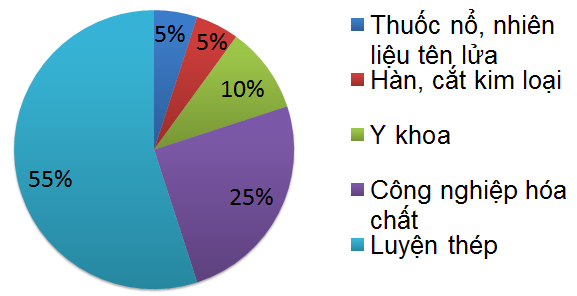
1.1.4. Ứng dụng
- Oxi có vai trò quyết định đối với sự sống của con người.
- Thuốc nổ nhiên liệu tên lửa.
- Hàn cắt kim loại
- Y khoa
- Công nghiệp hóa chất.
- Luyện thép.
Hình 2: Ứng dụng của khí oxi
1) Bình thở khí oxi 2) Hàn cắt kim loại
3) Luyện gang - thép 4) Nhiên liệu tên lửa
Hình 3: Biểu đồ những ứng dụng chính của Oxi
1.1.5. Điều chế
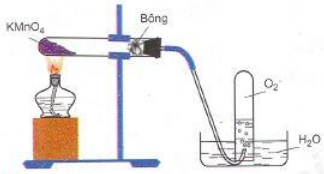
Điều chế khí oxi trong phòng thí nghiệm
- Nguyên tắc: Phân hủy hợp chất chứa oxi kém bền với nhiệt như KMnO4 (rắn), KClO3 (rắn), H2O2 ...
- Phương trình phản ứng:
2KMnO4 .PNG)
2KClO3 .PNG)
H2O2 .PNG)
Hình 4: Điều chế Oxi bằng cách nhiệt phân KMnO4
Video 6: Điều chế Oxi bằng cách nhiệt phân Kali pemanganat KMnO4
2KMnO4 .PNG)
Sản xuất Oxi trong công nghiệp
Từ không khí: chưng cất phân đoạn không khí lỏng
Video 7: Thí nghiệm ảo mô phỏng quá trình chưng cất phân đoạn không khí lỏng
Từ nước: điện phân
- Điện phân nước người ta thu được khí oxi ở cực dương (anot) và khí hiđro ở cực âm (catot).
2H2O (điện phân) → 2H2 ↑ + O2↑
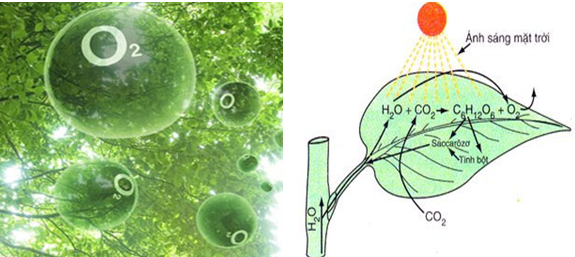
- Lưu ý: trong tự nhiên oxi còn đươc sinh ra do quá trình quang hợp của cây xanh. Nó có ý nghĩa làm giảm CO2 trong không khí, chống ô nhiễm môi trường. Do đó, cần phải có ý thức trồng và bảo vệ cây xanh vì đó cũng là bảo vệ cuộc sống của chính chúng ta.
Hình 5: Quá trình quang hợp tạo khí Oxi
1.2. OZON
1.2.1. Tính chất
- Ozon là một dạng thù hình của oxi. (Thù hình là các dạng cấu tạo khác nhau của cùng một nguyên tố, ví dụ như than chì và kim cương…)
- Ozon là chất khí màu xanh nhạt, có mùi đặc trưng.
- Hóa lỏng ở -1120 C.
- Tan nhiều trong nước hơn oxi.
- O3 có tính oxi hoá mạnh hơn O2, do O3 → O2 + O
O2 + Ag → không phản ứng
2Ag + O3 → Ag2O + O2
O3 +2 KI + H2O → 2KOH + I2 + O2 (Dấu hiệu nhận biết oxi và ozon)
1.2.2. Ozon trong tự nhiên
- Ozon được tạo thành trong khí quyển khi có sự phóng điện( tia chớp, sét).
3O2 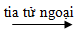
- Trên mặt đất, ozon được sinh ra do sự oxi hóa một số chất hữu cơ.
1.2.3. Ứng dụng
- Trong công nghiệp,người ta dùng ozon để tẩy trắng tinh bột, dầu ăn và nhiều vật phẩm khác,…
- Trong y học, Ozon được dùng để chữa sâu răng.
- Trong đời sống, người ta dùng ozon để sát trùng nước sinh hoạt.
- Lưu ý: Hiện nay tầng ozon đang bị phá huỷ nghiêm trọng, một trong những nguyên nhân đó là do trong khí thải có chất làm lạnh CFC. Tuy đã bị cấm nhưng hậu quả của nó còn để lại đến hàng trăm năm sau.
Bài 1:
Theo các em vì sao người bán cá thường xóc chậu cá, hoặc bao đựng cá hoặc dùng vòi sục khí vào chậu cá?
Hướng dẫn:
Người bán cá thường xóc chậu cá, hoặc bao đựng cá hoặc dùng vòi sục khí vào chậu cá để cung cấp oxi cho cá hô hấp. Vì khí Oxi ít tan trong nước.
Bài 2:
Có hai bình khí riêng biệt chứa O2 và O3. Hãy dùng phương pháp hóa học để phân biệt, viết phản ứng xảy ra
Hướng dẫn:
Dùng dung dịch KI có hồ tinh bột làm thuốc thử, nếu khí nào phản ứng với thuốc thử tạo dung dịch màu xanh đen là O3.
O3 + 2KI + H2O → I2 + 2KOH + O2
Bài 3:
Đốt cháy hoàn toàn 7,2 gam kim loại M (có hoá trị không đổi trong hợp chất) trong hỗn hợp khí Cl2 và O2. Sau phản ứng thu được 23 gam chất rắn và thể tích hỗn hợp khí đã phản ứng là 5,6 lít (ở đktc). Kim loại M là:
Hướng dẫn:
\(m\)rắn sau \(-\ m_M = m_{Cl_2} + m_{O_2} \Rightarrow 71n_{Cl_2} + 32n_{O_2} = 23 - 7,2 = 15,8 \ g\)⇒
\(n\)khí \(= n_{Cl_2} + n_{O_2} = 0,25\ mol\)
\(\Rightarrow n_{Cl_2} = 0,2;\ n_{O_2} = 0,05\ mol\)
Gọi hóa trị của M là x
⇒ Bảo toàn e: \(x \times n_M = 2n_{Cl_2} + 4n_{O_2}\)
\(\Rightarrow x \times \frac{7,2}{M} = 2 \times 0,2 + 4 \times 0,05\)
⇒ M = 12x
+) x = 2 ⇒ M = 24 g (Mg)
3. Luyện tập Bài 29 Hóa học 10
Sau bài học cần nắm:
- Tính chất hóa học cơ bản của khí Oxi và khí Ozon? Những phản ứng hóa học nào có thể chứng minh cho những tính chất này?
- Phương pháp điều chế khí Oxi như thế nào, vai trò của khí oxi đối với đời sống và sản xuất như thế nào?
- Ảnh hưởng khí Ozon đến đời sống trên Trái Đất như thế nào?
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 10 Bài 29 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. Chưng cất phân đoạn không khí lỏng.
- B. Điện phân nước.
- C. Điện phân dung dịch NaOH.
- D. Nhiệt phân KClO3 với xúc tác MnO2.
-
- A. Dung dịch NaOH.
- B. Dung dịch KI và hồ tinh bột.
- C. Dung dịch CrSO4.
- D. Dung dịch H2SO4.
-
- A. Khí oxi tan tốt nước
- B. Khí oxi khó hoá lỏng.
- C. Khí oxi ít tan trong nước.
- D. Khí oxi nhẹ hơn nước.
-
- A. Freon phá hủy tầng ozon.
- B. Freon gây ra hiệu ứng nhà kính.
- C. Freon gây ra mưa axit.
- D. Freon gây ra hiện tượng El Nino.
-
- A. Tăng, giảm hoặc không đổi phụ thuộc lượng C, S.
- B. Tăng.
- C. Giảm.
- D. Không đổi.
Câu 3- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 10 Bài 29.
Bài tập 29.16 trang 66 SBT Hóa học 10
Bài tập 1 trang 162 SGK Hóa học 10 nâng cao
Bài tập 2 trang 162 SGK Hóa học 10 nâng cao
Bài tập 3 trang 162 SGK Hóa học 10 nâng cao
Bài tập 4 trang 162 SGK Hóa học 10 nâng cao
Bài tập 5 trang 162 SGK Hóa học 10 nâng cao
Bài tập 1 trang 166 SGK Hóa học 10 nâng cao
Bài tập 2 trang 166 SGK Hóa học 10 nâng cao
Bài tập 3 trang 166 SGK Hóa học 10 nâng cao
Bài tập 4 trang 166 SGK Hóa học 10 nâng cao
Bài tập 5 trang 166 SGK Hóa học 10 nâng cao
Bài tập 6 trang 166 SGK Hóa học 10 nâng cao
4. Hỏi đáp về Bài 29 Chương 6 Hóa học 10
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Copyright © 2021 HOCTAP247