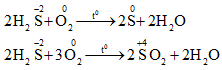Hoá học 10 Bài 32 Hiđro sunfua - Lưu huỳnh đioxit - Lưu huỳnh trioxit
Tóm tắt bài
1.1. HIĐRO SUNFUA
1.1.1. Tính chất vật lí
- Chất khí, có mùi trứng thối đặc trưng
- Rất độc và ít tan trong nước
- Nặng hơn KK (d = 34/29 ≈1,17)
1.1.2. Tính chất hóa học
Tính axít yếu
- Dung dịch axít sunfuhiđric (H2S): Tính axít rất yếu (yếu hơn axít cacbonic).
- Là axít 2 lần axit, có thể tạo ra 2 loại muối:
- Muối trung hòa: S2-
- Muối axít: HS-
- Ví dụ:
H2S + NaOH → NaHS + H2O
Natri hidrosunfua
H2S + 2NaOH → Na2S + 2H2O
Natri sunfua
- Để xác định muối tạo ra ta lập tỉ lệ mol: \(T = \frac{{{n_{NaOH}}}}{{{n_{{H_2}S}}}}\)
-
Nếu T ≤ 1 → muối NaHS
-
Nếu T ≥ 2 → muối Na2S
-
Nếu 1 2S
-
- Ví dụ: Cho 200ml dd NaOH 1M tác dụng với 100 ml dd H2S 1M. Có thể tạo ra những muối nào?
nNaOH = 0,2.1= 0,2 mol; nH2S = 0,1.1 = 0,1mol
T = 2 → tạo muối Na2S
Tính khử mạnh
Nguyên tố S trong H2S có số oxi hóa thấp nhất (-2)
→ H2S có tính khử mạnh. Số oxi hóa tăng từ -2 → 0 +4 +6 (Tính khử)
a. Tác dụng với oxi
- Dung dịch H2S: 2 H2S + O2 → 2S (màu vàng) + 2H2O
Hình 1: Đốt khí H2S trong điều kiện thiếu Oxi
- Khí H2S cháy trong khí với ngọn lửa màu xanh nhạt
b. Tác dụng với dung dich Br2
H2S + 4Br2 +4 H2O → H2SO4 + 8 HBr
(Màu vàng nâu ) (Không màu )
1.1.3. Trạng thái tự nhiên và điều chế
- Trạng thái tự nhiên: H2S tồn tại ở một số nước suối, trong khí núi lửa và bốc ra từ xác chết của người và động vật...
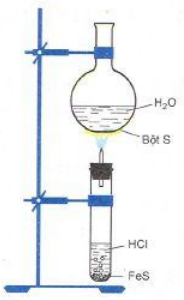
- Trong công nghiệp người ta không sản xuất hidro sunfua. Trong phòng thí nghiệm, người ta điều chế bằng phản ứng hóa học của dung dịch axit clohidric với Sắt (II) sunfua.
FeS + 2HCl → FeCl2 + H2S\(\uparrow\)
1.2. LƯU HUỲNH ĐIOXIT (SO2)
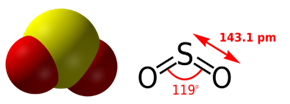
Hình 2: Cấu tạo phân tử SO2
1.2.1. Tính chất vật lí
- SO2 là chất khí không màu, mùi hắc, nặng hơn không khí, tan nhiều trong nước, có tính độc.
- SO2 hóa lỏng ở -10oC, ở 20oC 1 thể tích nước hòa tan được 40 thể tích khí SO2. Khí SO2 rất độc, hít phải không khí có khí này sẽ gây viêm đường hô hấp.
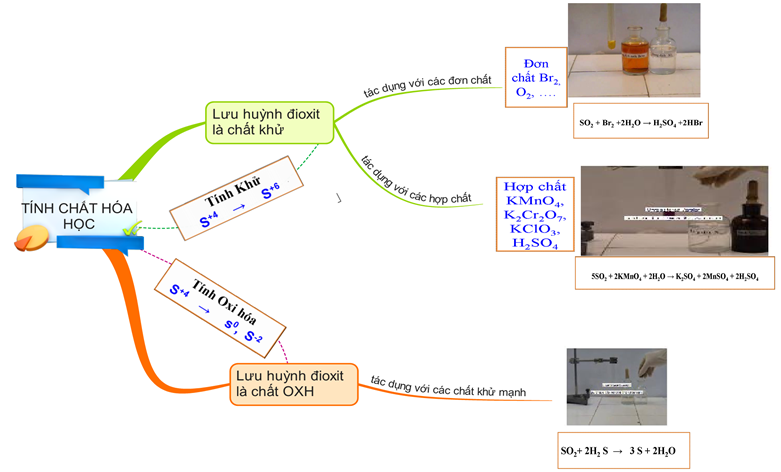
1.2.2. Tính chất hóa học
SO2 là oxit axit
- SO2 tan trong nước tạo dd axit yếu (mạnh hơn H2S và H2CO3), không bền gọi là axit sunfurơ.
SO2 + H2O 



- SO2 + Oxit bazơ → muối
- SO2 + Bazơ → muối axit hoặc muối trung hòa, tùy vào tỉ lệ mol của chất tham gia.
NaOH + SO2 → NaHSO3 (1)
Natri hidro sunfit
2NaOH + SO2 → Na2SO3 + H2O (2)
Natri sunfit
Đặt: \(T = \frac{{{n_{NaOH}}}}{{{n_{S{O_2}}}}}\)
- Nếu T 3 và SO2 dư.
- Nếu T=1 → sp NaHSO3
- Nếu 12SO3 và NaHSO3
- Nếu T = 2 → sp Na2SO3
- Nếu T>2 → sp Na2SO3 và NaOH dư.
SO2 là chất khử và là chất oxi hóa
a. SO2 là chất khử
- Đốt cháy SO2 trong không khí sẽ thu được khí SO3.
2SO2 + O2 
- Sục khí SO2 dư vào dd nước brôm (có màu vàng nâu).Sau phản ứng, dd nước brôm mất màu.
SO2 + Br2 + 2H2O → H2SO4 + 2HBr
(vàng nâu) (không màu)
- Sục khí SO2 vào dd thuốc tím. Sau phản ứng thuốc tím mất màu.
5SO2 + 2KMnO4 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4
(tím) (không màu)
→ Dùng để nhận biết SO2.
b. SO2 là chất oxi hóa
2SO2 + H2S → 3S + 2H2O
SO2 + 2Mg → S + 2MgO
KL: SO2 là oxit axit, có tính khử hoặc oxi hóa.
1.2.3. Ứng dụng và điều chế Lưu huỳnh đioxit
Ứng dụng
- Sản xuất H2SO4 trong phòng thí nghiệm
- Tẩy trắng giấy và bột giấy
- Chất chống ẩm mốc lương thực, thực phẩm...
Hình 3: Dây chuyền sản xuất axit sunfuric
Điều chế lưu huỳnh đioxit
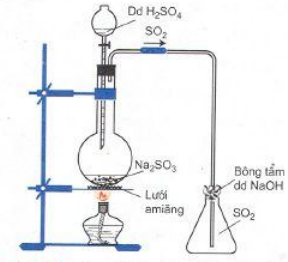
- Trong phòng thí nghiệm: H2SO4 + Na2SO3 → Na2SO4 + SO2 + H2O
Hình 4: Điều chế SO2 trong phòng thí nghiệm
- Trong Công nghiệp: Đốt lưu huỳnh hoặc quặng pirit sắt
S + O2 .PNG)
4FeS2+ 11O2 .PNG)
1.2.4. Tổng quát về SO2
Hình 5: Sơ đồ tư duy về lưu huỳnh đioxit (SO2)
1.3. LƯU HUỲNH TRIOXIT (SO3)
SO3 có tên gọi:
- Lưu huỳnh Trioxit
- Anhiđric Sunfuric
1.3.1. Tính chất
- SO3 là chất lỏng không màu, tan vô hạn trong nước và tan trong H2SO4 ta thu được hợp chất gọi là Oleum.
SO3 + H2O → H2SO4
nSO3 + H2SO4 → H2SO4.nH2O
- SO3 có đầy đủ tính chất của oxit axit, SO3 tác dụng với oxít bazơ, dung dịch bazơ tạo muối Sunfat.
SO3 + NaOH → NaHSO4
SO3 + 2NaOH → Na2SO4 + H2O
1.3.2. Ứng dụng và điều chế:
- Dùng để sản xuất H2SO4.
- Điều chế SO3 bằng cách oxi hóa SO2.
2SO2 + O2 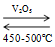
Bài 1:
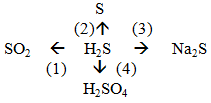
Trình bày tính chất hóa học của hiđro sunfua theo sơ đồ sau:
Hướng dẫn:
(1) 2H2S + 3O2 .PNG)
(2) 2H2S + O2 → 2S + 2H2O
(3) H2S + 2NaOH → Na2S +2H2O
(4) H2S + 4Br2 + H2O → H2SO4+ 8HBr
Bài 2:
Vì sao các đồ vật bằng bạc để lâu ngày trong không khí bị xám đen?
Hướng dẫn:
Ag để lâu ngày trong không khí bị hóa đen do phản ứng sau:
4Ag + 2H2S + O2 → 2Ag2S + 2H2O
Bài 3:
A là hỗn hợp khí gồm CO2 , SO2 dA/ H2 = 27. Dẫn a mol hh khí A qua bình đựng 1 lít dd NaOH 1,5aM. Sau phản ứng cô cạn cẩn thận dd thu được m (g) muối khan. Tìm m theo a?
Hướng dẫn:
Gọi CT chung của 2 oxit MO2 → MMO2 = 54 => M = 22(g)
Phương pháp nối tiếp
MO2 + 2NaOH → Na2MO3 + H2O
0,75a 1,5a → 0,75a
MO2 + Na2CO3 + H2O → 2NaHCO3
0,25a → 0,25a
Sau phản ứng
⇒ m = 0,5a . (46 + 22 + 48) + 0,5a . (24+22+48) = 105a
3. Luyện tập Bài 32 Hóa học 10
Sau bài học cần nắm:
- Tính chất vật lí, trạng thái tự nhiên, tính oxit axit, ứng dụng, phương pháp điều chế SO2, SO3.
- Nguyên nhân tính khử oxi hóa, khử: SO2 (vừa có tính oxi hóa, vừa có tính khử) và SO3 (chỉ có tính oxi hóa).
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hiđro sunfua - Lưu huỳnh đioxit - Lưu huỳnh trioxit có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. SO2 + Br2 + 2H2O → H2SO4 + 2HBr
- B. 5SO2+2KMnO4+2H2O → K2SO4+2MnSO4+2H2SO4
- C. SO2 + 2H2S → 3S + 2H2O
- D. 2SO2 + O2 → 2SO3
-
- A. Cho hh khí qua dd nước vôi trong.
- B. Cho hh khí qua dd brom dư.
- C. Cho hh khí qua dd NaOH.
- D. Cho hh khí qua dd Ba(OH)2.
-
Câu 3:
1 mẫu khí thải công nghiệp có nhiễm các khí CO; CO2; H2S. Để nhận biết H2S ta dùng dung dịch:
- A. Pb(CH3COO)2.
- B. FeSO4.
- C. NaNO3.
- D. Ca(OH)2.
-
- A. Cho mỗi khí vào nước Br2.
- B. Cho từ từ đến dư mỗi khí vào nước vôi trong.
- C. Cho mỗi khí vào dung dịch H2S.
- D. Cho mỗi khí vào dung dịch KMnO4.
-
- A. 3.
- B. 4.
- C. 2.
- D. 5.
-
Câu 6:
Cho phản ứng: H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
Câu nào diễn tả đúng tính chất của các chất phản ứng?
- A. H2S là chất oxi hoá, Cl2 là chất khử
- B. H2S là chất khử, H2O là chất oxi hoá
- C. Cl2 là chất oxi hoá, H2O là chất khử
- D. Cl2 là chất oxi hoá, H2S là chất khử
Câu 3- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hiđro sunfua - Lưu huỳnh đioxit - Lưu huỳnh trioxit.
Bài tập 32.16 trang 72 SBT Hóa học 10
Bài tập 32.17 trang 72 SBT Hóa học 10
Bài tập 32.18 trang 72 SBT Hóa học 10
Bài tập 32.19 trang 72 SBT Hóa học 10
Bài tập 2 trang 176 SGK Hóa học 10 nâng cao
Bài tập 3 trang 177 SGK Hóa học 10 nâng cao
Bài tập 4 trang 177 SGK Hóa học 10 nâng cao
Bài tập 5 trang 177 SGK Hóa học 10 nâng cao
Bài tập 1 trang 186 SGK Hóa học 10 nâng cao
Bài tập 2 trang 186 SGK Hóa học 10 nâng cao
Bài tập 4 trang 186 SGK Hóa học 10 nâng cao
Bài tập 5 trang 186 SGK Hóa học 10 nâng cao
4. Hỏi đáp về Bài 32 Chương 6 Hóa học 10
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Copyright © 2021 HOCTAP247