Hoá học 11 Bài 1: Sự điện li
Tóm tắt bài
1.1. Hiện tượng Điện li
1.1.1. Thí nghiệm
- Trong SGK trình bày cách tiến hành thí nghiệm đồng loạt bằng nguồn điện và hóa chất là NaCl khan, NaOH khan, sacarozơ, nước cất, dd NaCl , dd NaOH , dd sacarozo, ancol etylic.
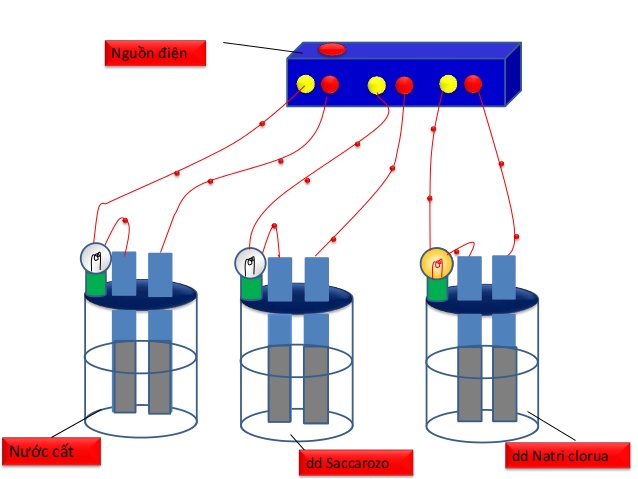
Hình 1: Bộ dụng cụ chứng minh sự dẫn điện của dung dịch
- Tuy nhiên, thí nghiệm này dụng cụ tiến hành thí nghiệm hơi rườm rà nên khi tiến hành cho học sinh quan sát, GV thường sử dụng thiết bị thử tính dẫn điện đơn giản như sau:
Video 1: Thí nghiệm Sự điện li
- Hiện tượng: Dd NaCl, HCl, NaOH, … làm đèn sáng. Dd saccarozơ, rượu etylic … không làm đèn phát sáng
- Giải thích: Cho dụng cụ thử tính dẫn điện vào lần lượt các cốc đựng các chất khác nhau. Bóng đèn phát sáng chứng tỏ chất đựng trong cốc đó có tính dẫn điện.
- Kết luận: Dung dịch Axit, bazơ và muối đều dẫn điện
1.1.2. Nguyên nhân tính dẫn điện của các dd axit, bazơ, muối trong nước.
- Các muối, axít, bazơ khi tan trong nước phân li ra các ion làm cho dd của chúng dẫn điện.
- Quá trình phân li các chất trong H2O ra ion là sự điện li.
- Những chất tan trong H2O phân li thành các ion gọi là chất điện li.
- Sự điện li được biểu diễn bằng pt điện li: NaCl → Na+ + Cl-
HCl → H+ + Cl-
NaOH → Na+ + OH-
1.2. Phân loại các chất điện li
1.2.1. Thí nghiệm
- Tiến hành thí nghiệm với chất điện li mạnh như dung dịch NaOH và chất điện li yếu như CH3COOH
Video 2: Tính dẫn điện của dung dịch chất điện li mạnh
Video 3: Tính dẫn điện của dung dịch chất điện li yếu
- Hiện tượng: Cả hai dung dịch đều làm bóng đèn phát sáng. Bóng đèn ở dung dịch axit axetic sáng mờ hơn ở dung dịch NaOH rất nhiều
- Giải thích: ở cùng nồng độ thì NaOH phân li ra ion nhiều hơn CH3COOH. Lượng ion càng nhiều thì tính dẫn điện càng tăng nên bóng đèn ở dung dịch NaOH sáng hơn.
- Nhận xét: Dựa vào mức độ phân li thành ion của các chất điện li khác nhau, người ta chia thành chất điện mạnh và chất điện li yếu.
1.2.2. Chất điện li mạnh, chất điện li yếu
*Chất điện li mạnh:
- Khái niệm: Chất điện li mạnh là chất khi tan trong nước, các phân tử hoà tan đều phân li ra ion.
- Phương trình điện li NaCl: (chú ý sử dụng mũi tên một chiều)
NaCl → Na+ + Cl-
100 ptử → 100 ion Na+ và 100 ion Cl-
- Bao gồm:
- Các axít mạnh HCl, HNO3, H2SO4…
- Các bazơ mạnh:NaOH, KOH, Ba(OH)2
- Hầu hết các muối.
- Ví dụ: Tính nồng độ của ion Na+ và SO42- trong dung dịch muối Na2SO4 0,1M
Dung dịch muối Na2SO4 là dung dịch chất điện li mạnh nên ta có phương trình ion như sau:
Na2SO4 → 2Na+ + SO42-
0,1M→ 0,2M → 0,1 M
Vậy nồng độ của ion Na+ là 0,2M; của ion SO42- là 0,1M
*Chất điện li yếu:
- Khái niệm: Chất điện li yếu là chất khi tan trong nước, chỉ có 1 phần số phân tử hoà tan phân li ra ion, phần còn lại vẫn tồn tại dưới dạng phân tử trong dung dịch.
- Phương trình điện li: (chú ý sử dụng 2 mũi tên ngược chiều nhau)
CH3COOH \(\leftrightarrows\) CH3COO- + H+
Ví dụ trong dung dịch CH3COOH cứ 100 phân tử hòa tan thì có 2 phân tử phân li thành ion, 98 phân tử còn lại không phân li.
- Ví dụ:
- Các axít yếu: H2S, HClO, CH3COOH, HF, H2SO3, HNO2, H3PO4, H2CO3, ...
- Bazơ yếu: Mg(OH)2, Bi(OH)3...
- Lưu ý: Quá trình phân li của chất điện li yếu là quá trình cân bằng động, tuân theo nguyên lí Lơ Satơliê.
Bài 1:
Xác định chất điện li mạnh, điện li yếu và viết phương trình điện li của các chất sau: HNO3, Mg(OH)2, Ba(OH)2, HCl, H2SO4, H2S
Hướng dẫn:
- Chất điện li mạnh là: HNO3, Ba(OH)2, HCl, H2SO4
HNO3 → H+ + NO3-
Ba(OH)2 → Ba2+ + 2OH-
HCl → H+ + Cl-
H2SO4 → 2H+ + SO42-
- Chất điện li yếu là: Mg(OH)2, H2S
Mg(OH)2 là bazơ ở dạng kết tủa nên phân li yếu. Mg(OH)2 \(\leftrightarrows\) Mg2+ + 2OH-
H2S là axit yếu nên phân li cũng yếu theo 2 nấc như sau:
H2S \(\leftrightarrows\) H+ + HS-
HS-\(\leftrightarrows\) H+ + S2-
Bài 2:
Tính nồng độ các ion trong các dung dịch sau
a. dd NaOH 0,1M b. dd BaCl2 0,2 M c. dd Ba(OH)2 0,1M
Hướng dẫn:
a. Phương trình điện li:
NaOH → Na+ + OH-
0,1M → 0,1M → 0,1 M
Vậy nồng độ của ion Na+ và OH- đều là 0,1 M
b. Phương trình điện li:
BaCl2 → Ba2+ + 2Cl-
0,1 M → 0,1 M → 0,2 M
Vậy nồng độ của ion Ba2+ là 0,1M và ion Cl- là 0,2M
c. Phương trình điện li:
Ba(OH)2 → Ba2+ + 2OH-
0,1M → 0,1M → 0,2 M
Bài 3:
Một dung dịch chứa 0,02 mol Cu2+, 0,03 mol K+, x mol Cl- và y mol SO42-. Tổng khối lượng muối tan có trong dung dịch là 5,435 gam. Xác định giá trị của x và y
Hướng dẫn:
Các ion trong dịch tồn tại cùng nhau vì ghép các ion không tạo kết tủa.
Áp dụng định luật bảo toàn điện tích ta có:
(1) 0,02.2 + 0,03.1 = x + 2y
Áp dụng định luật bảo toàn khối lượng thành phần ta có:
(2) 0,02.64 + 0,03.39 + 35,5x + 96.y = 5,435
Kết hợp (1) và (2) ta có hệ phương trình:
\(\left\{ \begin{array}{l} x + 2y = 0,07\\ 35,5x + 96y = 2,985 \end{array} \right. \Rightarrow \left\{ \begin{array}{l} x = 0,03(mol)\\ y = 0,02(mol) \end{array} \right.\)
Vậy số mol của ion Cl- là 0,03 mol; số mol của ion SO42- là 0,02 mol
3. Luyện tập Bài 1 Hóa học 11
Sau bài học cần nắm:
- Rèn luyện khả năng quan sát thí nghiệm rút ra được kết luận về tính dẫn điện của dung dịch chất điện li
- Phân biệt được chất điện li, chất không điện li, chất điện li mạnh, chất điện li yếu
- Viết được phương trình điện li của chất điện li mạnh, chất điện li yếu.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 11 Bài 1 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. Các electron chuyển động tự do.
- B. Các cation và anion chuyển động tự do.
- C. Các ion H+ và OH- chuyển động tự do.
- D. Các ion được gắn cố định tại các nút mạng.
-
- A. KCl rắn, khan.
- B. CaCl2 nóng chảy.
- C. NaOH nóng chảy.
- D. HBr hòa tan trong nước.
-
- A. Sự điện li là sự hoà tan một chất vào nước thành dung dịch.
- B. Sự điện li là sự phân li một chất dưới tác dụng của dòng điện.
- C. Sự điện li là sự phân li một chất thành ion khi tan trong nước hay ở trạng thái nóng chảy.
- D. Sự điện li là quá trình oxi hoá - khử.
-
- A. 3.
- B. 4.
- C. 5.
- D. 2.
-
- A. H+, CH3COO- .
- B. CH3COOH, H+, CH3COO-, H2O.
- C. H+, CH3COO-, H2O.
- D. CH3COOH, CH3COO-, H+.
-
Câu 6:
Trong các chất sau: K3PO4, H2SO4, HClO, HNO2, NH4Cl, HgCl2, Sn(OH)2. Các chất điện li yếu là:
- A. HClO, HNO2, HgCl2, Sn(OH)2.
- B. HClO, HNO2, K3PO4, H2SO4.
- C. HgCl2, Sn(OH)2, NH4Cl, HNO2.
- D. HgCl2, Sn(OH)2, HNO2, H2SO4.
-
- A. a, b, c, f.
- B. a, d, e, f.
- C. b, c, d, e.
- D. a, b, c, e.
Câu 2- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao Chương 1 Bài 1
Bài tập 1.3 trang 3 SBT Hóa học 11
Bài tập 1.4 trang 3 SBT Hóa học 11
Bài tập 1.5 trang 3 SBT Hóa học 11
Bài tập 1.6 trang 3 SBT Hóa học 11
Bài tập 1.7 trang 4 SBT Hóa học 11
Bài tập 1 trang 7 SGK Hóa học 11 nâng cao
Bài tập 2 trang 7 SGK Hóa học 11 nâng cao
Bài tập 3 trang 7 SGK Hóa học 11 nâng cao
Bài tập 4 trang 7 SGK Hóa học 11 nâng cao
Bài tập 5 trang 7 SGK Hóa học 11 nâng cao
Bài tập 6 trang 7 SGK Hóa học 11 nâng cao
Bài tập 7 trang 7 SGK Hóa học 11 nâng cao
4. Hỏi đáp về Bài 1: Sự điện li
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Copyright © 2021 HOCTAP247
