Hoá học 8 Bài 18: Mol
Tóm tắt bài
1.1. Mol là gì?
Hình 1: Một số đơn vị quy đổi thông dụng trong cuộc sống
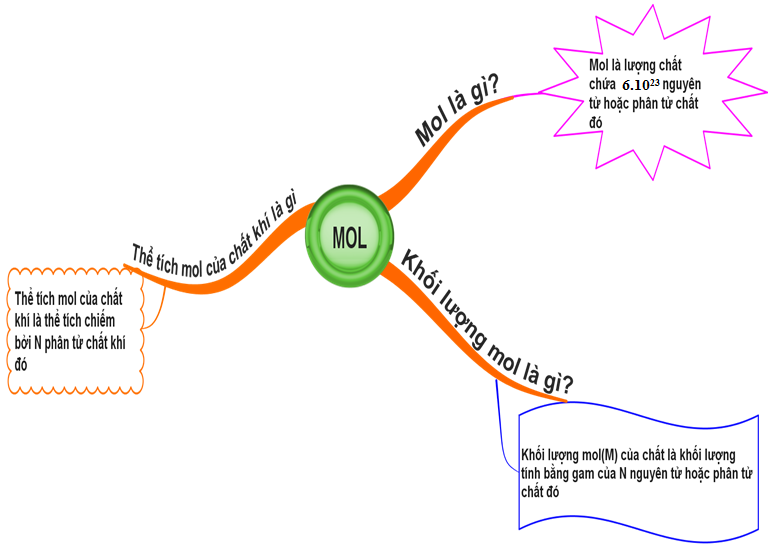
- Mol (n) là lượng chất chứa 6. 1023 nguyên tử hoặc phân tử chất đó.
- Con số 6 .1023 được gọi là số Avogadro và được kí hiệu là N.
- Ví dụ 1:
Hình 2: Một mol Sắt, nước, hiđro, đồng
- Nếu biết số mol ta có thể tính được số phân tử hoặc số nguyên tử.
- Ví dụ 2: Hãy tính số phân tử của NaCl có trong 2 mol NaCl?
- Cứ 1 mol muối có 6. 1023 phân tử muối ăn .
- Vậy 2 mol muối có 2 x 6. 1023 phân tử muối.
- Lưu ý: Phân biệt ý nghĩa của 2 cách viết sau:
- 1 mol H ⇒ Chỉ 1 mol nguyên tử Hiđro
-
1 mol H2 ⇒ Chỉ 1 mol phân tử Hiđro
1.2. Khối lượng mol là gì?
|
Nguyên tử khối ( hoặc phân tử khối) của một chất |
Khối lượng mol nguyên tử ( hoặc phân tử) của một chất |
|
Nguyên tử khối của Fe là: 56 đvC |
MFe = 56 (gam) |
| Phân tử khối của H2 là: 1x2 = 2 đvC | \({M_{{H_2}}} = 1 \times 2 = 2(gam)\) |
| Phân tử khối của H2O là: 1x2 + 16 = 18 đvC | \({M_{{H_2}O}} = 18(gam)\) |
- Khối lượng mol là khối lượng của N hạt phân tử hay nguyên tử chất đó.
- Khối lượng mol kí hiệu là M.
- Khối lượng mol của một chất có trị số bằng trị số của phân tử khối hoặc nguyên tử khối chất đó.
- Ví dụ:
- Khối lượng mol nguyên tử Hidro: MH = 1 gam/mol
- Khối lượng mol phân tử H2O : \({M_{{H_2}O}} = (1 \times 2 + 16) = 18(gam/mol)\)
-
Lưu ý: Phân biệt ý nghĩa của 2 cách viết sau:
-
MN: Chỉ khối lượng mol nguyên tử Nitơ
-
\({M_{{N_2}}}\) : Chỉ khối lượng mol phân tử Nitơ
1.3. Thể tích mol chất khí là gì?
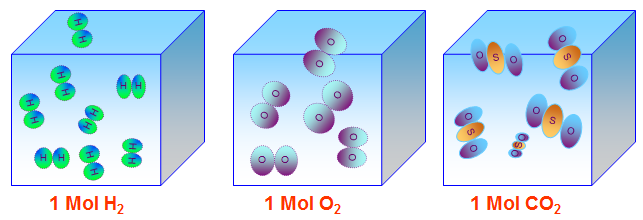
- Thể tích mol chất khí (V) là thể tích chiếm bởi N phân tử chất khí đó.
Hình 3: Mô hình của một mol chất khí bất kì trong cùng điều kiện nhiệt độ và áp suất.
- Điều kiện tiêu chuẩn (đktc): 00C và 1atm, 1 mol khí chiếm 22,4 lít
- Vậy: \({V_{{H_2}}} = {V_{{O_2}}} = {V_{C{O_2}}} = 22,4(lit)\)
-
Ở điều kiện bình thường là 200C và 1atm: 1 mol khí chiếm 24 lít
-
Vậy: \({V_{{H_2}}} = {V_{{O_2}}} = {V_{C{O_2}}} = 24(lit)\)
-
1.4. Tổng kết
Hình 4: Sơ đồ tư duy bài Mol
Bài 1:
a) Hãy tính số phân tử của H2O có trong 2 mol H2O?
b) Hãy tính số phân tử của KCl có trong 1,5 mol KCl?
Hướng dẫn:
a)Cứ 1 mol muối có 6. 1023 phân tử H2O.
Vậy 2 mol muối có 2 x 6. 1023 phân tử H2O.
b) Cứ 1 mol muối có 6. 1023 phân tử KCl.
Vậy 2 mol muối có 1,5 x 6. 1023 phân tử KCl.
Bài 2:
Hoàn thành bảng sau:
|
Số mol nguyên tử (hoặc phân tử) chất |
Số nguyên tử (hoặc phân tử) của chất |
| 1 mol nguyên tử Đồng | có ..................nguyên tử Đồng |
| .............................. nguyên tử Cacbon |
Có 18.1023 nguyên tử Cacbon |
|
2,5 mol phân tử SO2 |
có ......................... phân tử SO2 |
Hướng dẫn:
|
Số mol nguyên tử (hoặc phân tử) chất |
Số nguyên tử (hoặc phân tử) của chất |
| 1 mol nguyên tử Đồng | có 6.1023 nguyên tử Đồng |
| \(\frac{{{{18.10}^{23}}}}{{{{6.10}^{23}}}} = 3(mol)\) nguyên tử Cacbon |
Có 18.1023 nguyên tử Cacbon |
|
2,5 mol phân tử SO2 |
có 2,5. 6. 1023 = 15. 1023 phân tử SO2 |
Bài 3:
Hãy tính khối lượng mol của các chất sau:
Can xi (Ca), Đồng (II) oxit (CuO), Canxi cacbonat (CaCO3)
Hướng dẫn:
|
Chất |
Khối lượng mol (M) của chất |
| Can xi (Ca) | \({M_{Ca}} = 40(gam)\) |
| Đồng (II) oxit (CuO) | \({M_{CuO}} = 64 + 16 = 80(gam)\) |
| Canxi cacbonat (CaCO3) | \({M_{CaC{O_3}}} = 40 + 12 + 16 \times 3 = 100(gam)\) |
3. Luyện tập Bài 18 Hóa học 8
Sau bài học cần nắm:
- Mol là gì? Khối lượng mol là gì? Thể tích mol chất khí là gì?
- Xác định được khối lượng mol chất, mol chất khi biết số phân tử và ngược lại.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 8 Bài 18 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. 6.1023 phân tử
- B. 6.1023 nguyên tử
- C. 9.1023 nguyên tử
- D. 7,5.1023 nguyên tử
-
- A. 27 gam
- B. 32 gam
- C. 100 gam
- D. 108 gam
-
- A. 22,4 lit
- B. 1,12 lit
- C. 44,8 lit
- D. 24 lit
Câu 3- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 8 Bài 18.
Bài tập 1 trang 65 SGK Hóa học 8
Bài tập 2 trang 65 SGK Hóa học 8
Bài tập 3 trang 65 SGK Hóa học 8
Bài tập 4 trang 65 SGK Hóa học 8
Bài tập 18.1 trang 26 SBT Hóa học 8
Bài tập 18.2 trang 26 SBT Hóa học 8
Bài tập 18.3 trang 26 SBT Hóa học 8
Bài tập 18.4 trang 26 SBT Hóa học 8
Bài tập 18.5 trang 26 SBT Hóa học 8
4. Hỏi đáp về Bài 18 Chương 3 Hóa học 8
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Copyright © 2021 HOCTAP247


.PNG)