Hoá học 8 Bài 23: Bài luyện tập 4
Tóm tắt bài
1.1. Mol
|
Các cụm từ sau có nghĩa thế nào ? |
Ý nghĩa |
|
1 mol nguyên tử Cu |
1N nguyên tử Cu hay 6.1023 nguyên tử Cu |
|
1,5 mol nguyên tử H |
1,5 N nguyên tử H hay 1,5.6.1023 nguyên tử H (9.1023) |
|
2 mol phân tử H2 |
2N phân tử H2 hay 2.6.1023 phân tử H2 (12.1023) |
|
0,15 mol phân tử H2O |
0,15N phân tử H2O hay 0,15.6.1023 phân tử H2O (0,9.1023) |
1.2. Khối lượng mol
|
Các câu sau có nghĩa thế nào ? |
Ý nghĩa |
|
Khối lượng mol của nước là 18 g/mol |
Khối lượng N phân tử nước là 18 g. Kí hiệu là \({M_{{H_2}O}}\) = 18g/mol |
|
Khối lượng mol nguyên tử H là 1g/mol |
Khối lượng N nguyên tử H là 1 g. Kí hiệu là MH = 1g/mol |
|
Khối lượng mol phân tử H2 là 2 g/mol |
Khối lượng N phân tử hiđro là 2 g. Kí hiệu là \({M_{{H_2}}}\) = 2g/mol |
1.3. Thể tích mol chất khí
|
Ở cùng điều kiện nhiệt độ và áp suất thể tích mol của khí CO2, O2, H2. |
\({V_{C{O_2}}} = {V_{{O_2}}} = {V_{{H_2}}}\) |
|
Ở ( đktc) Thể tích mol các chất khí CO2, O2, H2 |
\({V_{C{O_2}}} = {V_{{O_2}}} = {V_{{H_2}}} = 22,4(lit)\) |
|
Thể tích mol của những chất khí khác nhau, ở cùng điều kiện nhiệt độ và áp suất. |
Bằng nhau |
|
Thể tích mol của những chất khí khác nhau, ở cùng điều kiện nhiệt độ 0oC và áp suất 1 atm. |
Bằng nhau và bằng 22,4 lit |
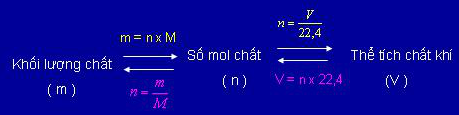
Hình 1: Sự chuyển đổi giữa lượng chất (số mol) - khối lượng chất - thể tích chất khí (đktc)
1.4. Tỉ khối của chất khí
|
Tỉ khối của khí A đối với khí B ( dA/B = 1,5)
|
Khí A nặng hơn khí B 1,5 lần |
|
Tỉ khối của khí CO2 đối với không khí bằng 1,52
|
khí CO2 nặng hơn không khí 1,52 lần. |
Bài 1:
Trong phòng thí nghiệm, người ta cho 4,6 gam Natri (Na) phản ứng với khí clo (Cl2) sau phản ứng thu được muối Natri clorua (NaCl)
2Na + Cl2 .PNG)
a, Tính thể tích khí clo (ở đktc) cần dùng để phản ứng hết số Natri trên?
b, Tính khối lượng muối Natriclorua tạo thành?
c, Khí clo nặng hay nhẹ hơn không khí bao nhiêu lần?
Hướng dẫn:
a) Số mol Natri tham gia phản ứng là:
\({n_{Na}} = \frac{{{m_{Na}}}}{M} = \frac{{4,6}}{{23}} = 0,2(mol)\)
Phương trình phản ứng:
2Na + Cl2 .PNG)
2 mol 1 mol 2 mol
0,2 mol → ? mol ? mol
Số mol clo dùng để phản ứng hết lượng Natri là:
\({n_{C{l_2}}} = \frac{{0,2 \times 1}}{2} = 0,1(mol)\)
Thể tích khí Clo cần dùng là:
\({V_{C{l_2}}} = {n_{C{l_2}}} \times 22,4 = 0,1 \times 22,4 = 2,24(lit)\)
b) Số mol muối Natri tạo thành là: 0,2 mol
Khối lượng muối Natri tạo thành là:
\({{\rm{m}}_{{\rm{Na}}}}{\rm{ = }}{{\rm{n}}_{{\rm{Na}}}}{\rm{.M = 0,2}}{\rm{.23 = 4,6(g)}}\)
c) Khí Clo nặng hơn không khí số lần là:
\({d_{C{l_2}/KK}} = \frac{{{M_{C{l_2}}}}}{{29}} = \frac{{35,5 \times 2}}{{29}} \approx 2,45\)
3. Luyện tập Bài 23 Hóa học 8
Sau bài học cần nắm:
- Khái niệm: mol, khối lượng mol, thể tích mol chất khí, tỉ khối của chất khí...
- Tổng kết lại mối quan hệ giữa khối lượng chất, thể tích khí
- Vận dụng kiến thức giải bài tập và hiểu các hiện tượng trong thực tế.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 8 Bài 23 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. CO
- B. CO2
- C. CH4
- D. SO2
-
- A. Đều là đơn chất
- B. Đều có cùng số mol
- C. Đều có cùng số nguyên tử lưu huỳnh
- D. Đều có cùng số nguyên tử hidro
-
- A. FeS
- B. FeS2
- C. FeO
- D. Fe2O3
-
- A. Cu2S và Cu2O
- B. CuS và CuO
- C. CuS và Cu2O
- D. Cu2S và CuO
Câu 3- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 8 Bài 23.
Bài tập 2 trang 79 SGK Hóa học 8
Bài tập 3 trang 79 SGK Hóa học 8
Bài tập 4 trang 79 SGK Hóa học 8
Bài tập 5 trang 79 SGK Hóa học 8
Bài tập 23.1 trang 30 SBT Hóa học 8
Bài tập 23.2 trang 30 SBT Hóa học 8
Bài tập 23.3 trang 31 SBT Hóa học 8
Bài tập 23.4 trang 31 SBT Hóa học 8
Bài tập 23.5 trang 31 SBT Hóa học 8
Bài tập 23.6 trang 31 SBT Hóa học 8
Bài tập 23.7 trang 31 SBT Hóa học 8
Bài tập 23.8 trang 31 SBT Hóa học 8
4. Hỏi đáp về Bài 23 Chương 3 Hóa học 8
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Copyright © 2021 HOCTAP247