Hoá học 9 Bài 18: Nhôm
Tóm tắt bài
1.1. Tính chất vật lí
Màu trắng bạc, có ánh kim, nhẹ (D= 2,7g/cm3), dẫn điện,dẫn nhiệt tốt, nóng chảy ở 6600C ,dẻo.
Hình 1: Tính chất vật lí của Nhôm
1.2. Tính chất hoá học
1.2.1. Nhôm có những tính chất hoá học của kim loại không?
-
Phản ứng của nhôm với phi kim
-
Phản ứng của nhôm với oxi
Video 1: Phản ứng giữa Nhôm và oxi
- Hiện tượng: Nhôm cháy sáng trong oxi
- Giải thích: Al2O3 mỏng, bền trong không khí
4Al + 3O2 .PNG)
trắng không màu trắng
- Phản ứng của nhôm với phi kim khác
Video 2: Nhôm phản ứng với Clo
- Hiện tượng: Nhôm cháy sáng trong oxi
- Giải thích: Nhôm phản ứng với oxi tạo thành oxít và phản ứng với nhiều phi kim khác như S,Cl.. tạo thành muối
2Al + 3Cl2 .PNG)
trắng vàng lục trắng
- Phản ứng của Nhôm với dung dịch axit
Video 3: Thí nghiệm của Nhôm và dung dịch HCl
- Hiện tượng: Xuất hiện khí không màu
- Giải thích: Nhôm phản ứng với một số axít tạo thành muối và H2
2Al + 6HCl → 2AlCl3 + 3H2
- Phản ứng của nhôm với dd muối
Video 4: Phản ứng giữa Nhôm và dung dịch muối Đồng (II) clorua CuCl2
- Hiện tượng: Có lớp kim loại màu nâu đỏ bám lên trên miếng nhôm
- Giải thích: Lớp kim loại màu nâu đỏ là Cu
2Al+3CuCl2 → 2AlCl3+3Cu
- Nhôm phản ứng được với nhiều dd muối của những kim loại hoạt động hoá học yếu hơn tạo ra muối nhôm và kim loại mới
Kết luận :Nhôm có những tính chất hoá học của kim loại.
1.2.2. Nhôm có tính chất hóa học nào khác
Video 5: Nhôm có tác dụng với dung dịch kiềm
- Hiện tượng: Có khí nào thoát ra, nhôm tan dần
- Giải thích: Nhôm có tác dụng với dung dịch kiềm
1.3. Ứng dụng của nhôm
Hình 2: Ứng dụng của nhôm
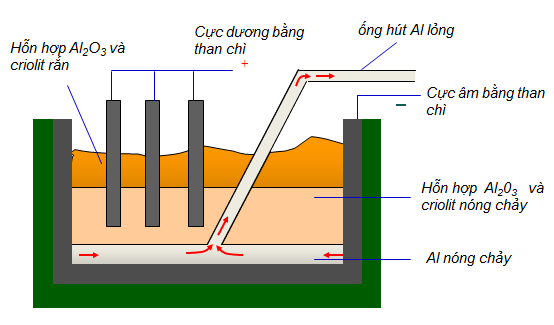
1.4. Sản xuất Nhôm
Hình 3: Sơ đồ bể điện phân nhôm oxit nóng chảy
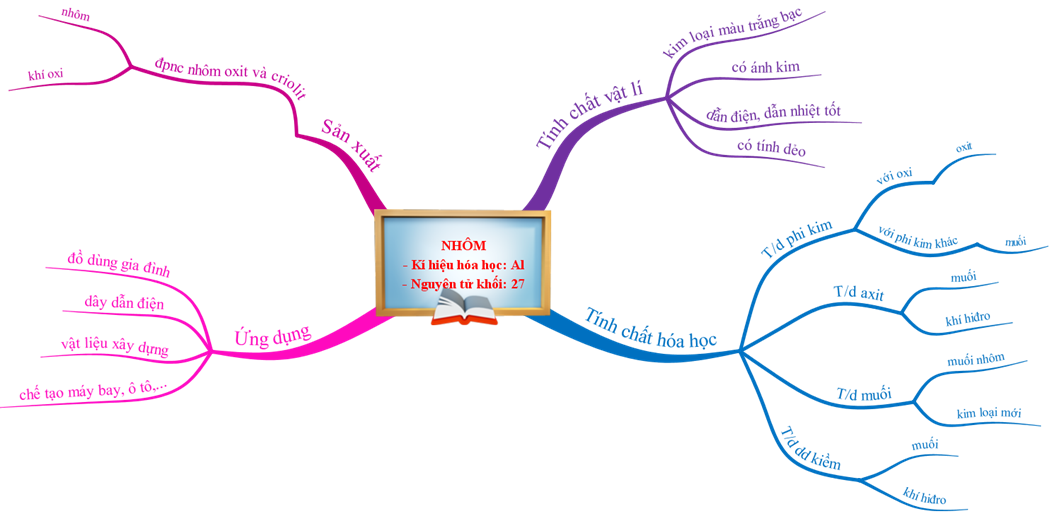
1.5. Tổng kết
Hình 4: Sơ đồ tư duy bài Nhôm
Bài 1:
Trộn 5,4 g Al với 4,8 g Fe2O3 rồi nung nóng để thực hiện phản ứng nhiệt nhôm. Sau phản ứng ta thu được m (gam) hỗn hợp chất rắn. Giá trị của m là:
Hướng dẫn:
Phương trình phản ứng:
2Al + Fe2O3 → Al2O3 + 2Fe
Nhận thấy, khối lượng trước phản ứng luôn bằng khối lượng các chất sau phản ứng. Các chất sau phản ứng là Al2O3 và Fe đều là chất rắn nên ta có:
m hỗn hợp sau phản ứng \(= m_{Al} + m_{Fe_2O_3} = 5,4 + 4,8 = 10,2\ g\)
3. Luyện tập Bài 18 Hóa học 9
Sau bài học cần nắm:
- Tính chất vật lí của nhôm: nhẹ, dẻo, dẫn điện, dẫn nhiệt tốt.
- Tính chất hoá học của nhôm: Nhôm có tính chất hoá học của kim loại nói chung. Ngoài ra nhôm còn có pứ với dd kiềm giải phóng khí H2, nhôm không phản ứng HNO3 đặc nguội và H2SO4 đặc nguội.
- Phương pháp sản xuất nhôm bằng cách điện phân nhôm oxit nóng chảy.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 9 Bài 18 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. Mg
- B. Ca
- C. Al
- D. Fe
-
- A. Dung dịch HCl
- B. Dung dịch CuSO4
- C. Dung dịch NaOH
- D. Nước
-
- A. Zn và HCl
- B. Fe và AgNO3
- C. Mg và
- D. HCl và AgNO3
-
- A. 10,08.
- B. 6,72.
- C. 7,84.
- D. 11,2.
-
- A. 12,096
- B. 4,032
- C. 24,192
- D. 8,064
Câu 2- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 9 Bài 18.
Bài tập 4 trang 58 SGK Hóa học 9
Bài tập 5 trang 58 SGK Hóa học 9
Bài tập 6 trang 58 SGK Hóa học 9
Bài tập 18.1 trang 22 SBT Hóa học 9
Bài tập 18.2 trang 22 SBT Hóa học 9
Bài tập 18.3 trang 22 SBT Hóa học 9
Bài tập 18.4 trang 22 SBT Hóa học 9
Bài tập 18.5 trang 23 SBT Hóa học 9
Bài tập 18.6 trang 23 SBT Hóa học 9
Bài tập 18.7 trang 23 SBT Hóa học 9
Bài tập 18.8 trang 23 SBT Hóa học 9
Bài tập 18.9 trang 23 SBT Hóa học 9
4. Hỏi đáp về Bài 18 chương 2 Hóa học 9
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Copyright © 2021 HOCTAP247