Trang chủ
Đề thi & kiểm tra
Lớp 9
Hóa học
Đề thi chính thức vào 10 môn Hóa Hệ chuyên THPT Chuyên TP Hồ Chí Minh năm 2015 2016 (có lời giải chi tiết)
Đề thi chính thức vào 10 môn Hóa Hệ chuyên THPT Chuyên TP Hồ Chí Minh năm 2015 2016 (có...
Lời giải có ở chi tiết câu hỏi nhé! (click chuột vào câu hỏi).
Copyright © 2021 HOCTAP247

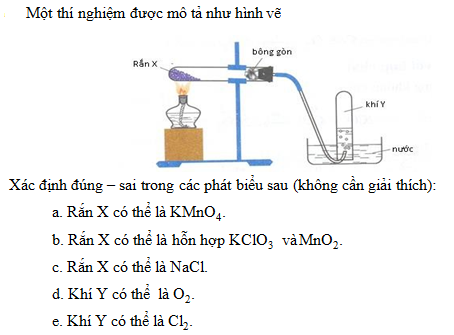
 2. Có 5 dung dịch (mỗi dung dịch chỉ chứa 1 chất tan) trong 5 lọ riêng biệt gồm các chất: Na2CO3, BaCl2, MgCl2, H2SO4, NaOH được đánh số bất kì (1), (2), (3), (4), (5). Tiến hành thực hiện các thí nghiệm thì nhận được kết quả sau:- Chất ở lọ (1) tác dụng với chất ở lọ (2) cho khí thoát ra.- Chất ở lọ (1) tác dụng với chất ở lọ (4) thấy xuất hiện kết tủa.- Chất ở lọ (2) cho kết tủa trắng khi tác dụng với chất ở lọ (4) và lọ (5).Xác định chất có trong các lọ (1), (2), (3), (4), (5). Giải thích và viết các phương trình hóa học xảy ra.3.
2. Có 5 dung dịch (mỗi dung dịch chỉ chứa 1 chất tan) trong 5 lọ riêng biệt gồm các chất: Na2CO3, BaCl2, MgCl2, H2SO4, NaOH được đánh số bất kì (1), (2), (3), (4), (5). Tiến hành thực hiện các thí nghiệm thì nhận được kết quả sau:- Chất ở lọ (1) tác dụng với chất ở lọ (2) cho khí thoát ra.- Chất ở lọ (1) tác dụng với chất ở lọ (4) thấy xuất hiện kết tủa.- Chất ở lọ (2) cho kết tủa trắng khi tác dụng với chất ở lọ (4) và lọ (5).Xác định chất có trong các lọ (1), (2), (3), (4), (5). Giải thích và viết các phương trình hóa học xảy ra.3.