Cho 13,12 gam dung dịch X gồm Cu(NO3)2 28,66% và HNO3 tác dụng hoàn toàn với 105ml dung dịch KOH 1M, sau đó lọc bỏ kết tủa được dung dịch Y. Cô cạn Y được chất rắn Z. Nung Z đến kh...
Câu hỏi :
Cho 13,12 gam dung dịch X gồm Cu(NO3)2 28,66% và HNO3 tác dụng hoàn toàn với 105ml dung dịch KOH 1M, sau đó lọc bỏ kết tủa được dung dịch Y. Cô cạn Y được chất rắn Z. Nung Z đến khối lượng không đổi, thu được 8,78 gam chất rắn.
a) Viết các phương trình hóa học.
b) Xác định nồng độ phần trăm của HNO3 trong dung dịch X.
Cho 13,12 gam dung dịch X gồm Cu(NO3)2 28,66% và HNO3 tác dụng hoàn toàn với 105ml dung dịch KOH 1M, sau đó lọc bỏ kết tủa được dung dịch Y. Cô cạn Y được chất rắn Z. Nung Z đến khối lượng không đổi, thu được 8,78 gam chất rắn.
a) Viết các phương trình hóa học.
b) Xác định nồng độ phần trăm của HNO3 trong dung dịch X.
* Đáp án
* Hướng dẫn giải
a) Số mol các chất là:
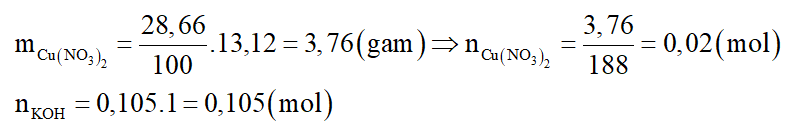
Dung dịch X tác dụng với dung dịch KOH:
Các phương trình hóa học:
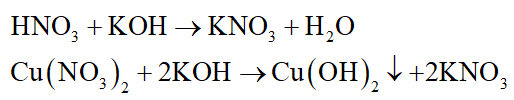
X tác dụng hết với KOH nên các chất trong X hết, KOH có thể dư.
Dung dịch Y gồm KNO3 và có thể có KOH dư. Cô cạn dung dịch Y thì nước bay hơi, do đó chất rắn Z gồm KNO3 và KOH dư.
Nung chất rắn Z:
Phương trình hóa học:
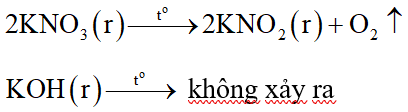
Nung Z đến khối lượng không đổi nên KNO3 hết.
Chất rắn thu được là KNO2 và KOH dư.
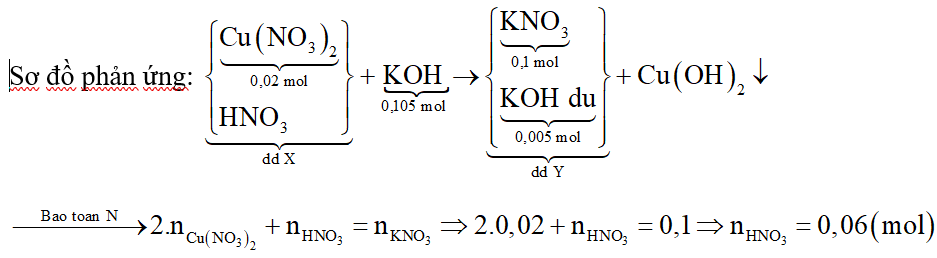
b) Chứng minh dung dịch Y gồm KNO3 và KOH dư:
Cho dù KOH dư hay hết thì dung dịch Y luôn có KNO3.
Nếu KOH hết thì K trong KOH sẽ chuyển hết về K trong KNO2. Ta có:
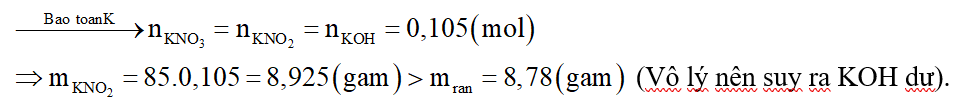
Xét giai đoạn nung chất rắn Z:
Gọi số mol các chất trong rắn Z là KNO3: a mol; KOH dư: b mol.
K trong rắn Z chính là K trong KOH ban đầu nên ta có:
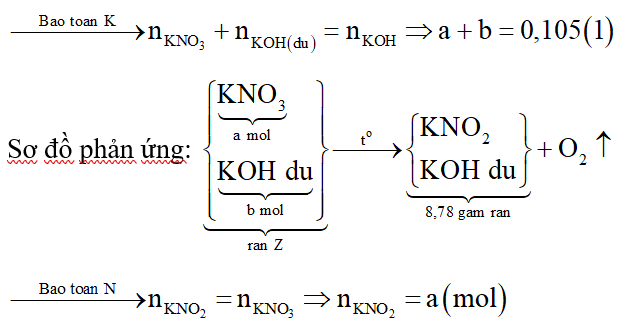
Khối lượng chất rắn là:
Tổ hợp (1) và (2) ta được: a = 0,1 mol; b = 0,005 mol.
Xét giai đoạn dung dịch X tác dụng với KOH:
Nồng độ phần trăm HNO3 trong dung dịch X là:
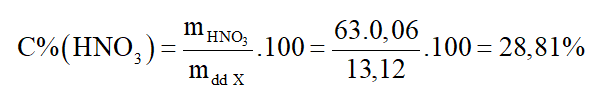
*Chú ý: Không được lấy 100 trừ đi nồng độ phần trăm của Cu(NO3)2 để tính nồng độ phần trăm của HNO3 vì dung dịch còn có nước.
Câu hỏi trên thuộc đề trắc nghiệm dưới đây !
Trắc nghiệm tổng hợp Hóa 9 Chương 1: Các loại hợp chất vô cơ có đáp án !!
Copyright © 2021 HOCTAP247
