Hoá học 8 Bài 41: Độ tan của một chất trong nước
Tóm tắt bài
1.1. Chất tan và chất không tan
a) Thí nghiệm về tính tan của chất
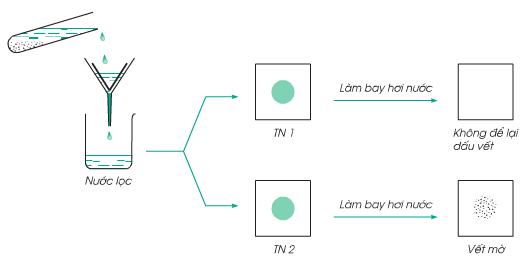
- Thí nghiệm 1: Hòa tan cát và muối vào nước
Hình 1: So sánh tính tan của cát và muối trong nước
Nhận xét: Muối tan tốt trong nước, cát không tan trong nước.
Kết luận: Có chất tan, có chất không tan trong nước.
- Thí nghiệm 2: Thử tính tan ít hay nhiều của đá vôi (CaCO3) trong nước
Hình 2: Sự tan nhiều hay ít của chất tan
Kết luận: Có chất tan nhiều, có chất tan ít trong nước
b) Tính tan trong nước của một số axit, bazơ và muối
Hình 3: Bảng tính tan của các chất
- Hầu hết axit tan trong nước trừ axit silixic (H2SiO3)
- Bazơ hầu hết không tan trong nước trừ KOH, NaOH, Ba(OH)2 còn Ca(OH)2 ít tan
Hình 4: Màu sắc của một số kết tủa
- Muối:
- Muối của Na, K đều tan như KCl, NaNO3, ...
- Muối nitrat đều tan như Ba(NO3)2, Mg(NO3)2
- Phần lớn muối clorua, sunfat tan. Muối cacbonat đều không tan. Muối CuCl2 (tan), AgCl (không tan), K2SO4 (tan), BaSO4 (không tan)...
1.2. Độ tan của một chất trong nước
a) Định nghĩa
-
Độ tan (S) của một chất trong nước là số gam chất đó hòa tan trong 100 gam H2O để tạo thành dung dịch bão hòa ở nhiệt độ xác định.
-
Ví dụ: Ở 250C khi hòa tan 36 gam muối NaCl vào 100 gam nước thì người ta thu được dung dịch muối bão hòa. Người ta nói độ tan của NaCl ở 250C là 36 gam.
b) Những yếu tố ảnh hưởng đến độ tan
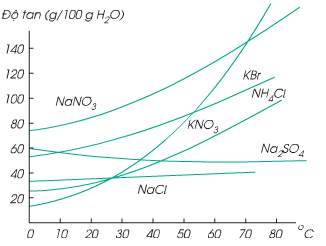
- Độ tan của chất rắn phụ thuộc vào nhiệt độ. Nhiệt độ càng cao thì độ tan càng lớn
Hình 5: Ảnh hưởng của nhiệt độ đến độ tan của chẩt rắn
- Độ tan của chất khí phụ thuộc vào nhiệt độ và áp suất. Nhiệt độ và áp suất càng lớn thì độ tan càng lớn.
Hình 6: Ảnh hưởng của nhiệt độ đến độ tan của chất khí
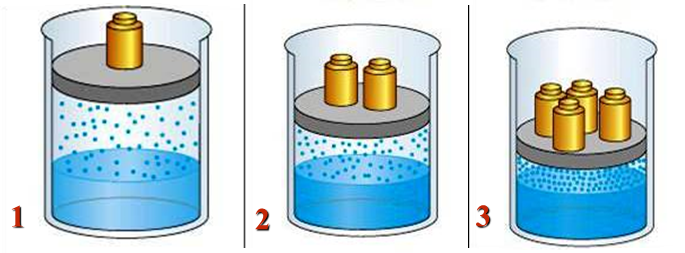
- Ví dụ: Ta tiến hành thí nghiệm hòa tan của chất khí khi tăng áp suất. Với cùng lượng chất khí và nước nhưng ta lần lượt giảm thể tích ở bình 2 và 3 theo mức độ tăng dần như hình vẽ:
Hình 7: Ảnh hưởng của áp suất đến độ tan của chất khí
Nhận xét: Nhiệt độ và áp suất càng lớn thì độ tan càng lớn ⇒ Lượng khí hòa tan trong bình 3 là nhiều nhất.
Bài 1:
Tại sao khi mở nắp chai nước ngọt thì có ga?
Hướng dẫn:
Tại nhà máy, khi sản xuất người ta nén khí cacbonic vào các chai nước ngọt ở áp suất cao rồi đóng nắp chai nên khí cacbonnic tan bão hòa vào nước ngọt. Khi ta mở chai nước ngọt áp suất trong chai giảm, độ tan của khí cacbonic giảm nên khí cacbonic thoát ra ngoài kéo theo nước.
Bài 2:
Em hãy giải thích tại sao trong các hồ cá cảnh hoặc các đầm nuôi tôm người ta phải “Sục” không khí vào hồ nước.
Hướng dẫn:
Do khí oxi ít tan trong nước nên người ta “Sục” không khí nhằm hòa tan nhiều hơn khí oxi giúp tôm, cá hô hấp tốt hơn. Từ đó nâng cao năng suất.
Bài 3:
Xác định độ tan của muối NaCl trong nước ở 200C. Biết rằng ở 200C khi hòa tan hết 60g NaCl trong 200g nước thì thu được dung dịch bão hòa.
Hướng dẫn:
Độ tan (S) của một chất trong nước là số gam chất đó hòa tan trong 100 gam H2O để tạo thành dung dịch bão hòa ở nhiệt độ xác định.
Đề bài cho 200 gam nước nên ta có:
60 gam NaCl hòa tan trong 200 gam nước
? gam NaCl \(\leftarrow\) trong 100 gam nước
Vậy độ tan có giá trị là: \(\frac{{60.100}}{{200}} = 30(gam)\)
Bài 4:
Tìm khối lượng đường cần dùng để hòa tan vào 250 gam nước ở 200C để tạo thành dung dịch bão hòa. Biết ở 200C độ tan của đường là 200 gam.
Hướng dẫn:
Dữ kiện cho độ tan của đường là 200 gam có nghĩa là:
Cứ 100 gam nước sẽ hòa tan 200 gam đường
Vậy 250 gam nước → ? gam đường
Vậy khối lượng đường cần dùng để tạo thành dung dịch bão hòa là:
\(\frac{{250.200}}{{100}} = 500(gam)\)
3. Luyện tập Bài 41 Hóa học 8
Sau bài học cần nắm:
- Chất tan và chất không tan
- Độ tan của một chất trong nước
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 8 Bài 41 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. Tăng
- B. Giảm
- C. Có thể tăng hoặc giảm
- D. Không thay đổi
-
- A. Đều tăng
- B. Đều giảm
- C. Phần lớn tăng
- D. Phần lớn giảm
-
- A. Số gam chất đó tan trong 100g dung dịch.
- B. Số gam chất đó tan trong 100g dung môi
- C. Số gam chất đó tan trong nước tạo ra 100g dung dịch
- D. Số gam chất đó tan trong 100g nước để tạo dung dịch bão hoà
Câu 3- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 8 Bài 41.
Bài tập 1 trang 142 SGK Hóa học 8
Bài tập 2 trang 142 SGK Hóa học 8
Bài tập 3 trang 142 SGK Hóa học 8
Bài tập 4 trang 142 SGK Hóa học 8
Bài tập 5 trang 142 SGK Hóa học 8
Bài tập 41.1 trang 56 SBT Hóa học 8
Bài tập 41.2 trang 56 SBT Hóa học 8
Bài tập 41.3 trang 56 SBT Hóa học 8
Bài tập 41.4 trang 56 SBT Hóa học 8
Bài tập 41.5 trang 56 SBT Hóa học 8
Bài tập 41.6 trang 57 SBT Hóa học 8
Bài tập 41.7 trang 57 SBT Hóa học 8
4. Hỏi đáp về Bài 41 Chương 6 Hóa học 8
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Copyright © 2021 HOCTAP247


.PNG)



.PNG)