Hoá học 8 Bài 45: Bài thực hành 7
Tóm tắt bài
1.1. Nội dung ôn tập
a. Nồng độ phần trăm của dung dịch
- Nồng độ phần trăm (C%) của một dung dịch cho ta biết số gam chất tan có trong 100 gam dung dịch.
- Công thức tính nồng độ phần trăm của dung dịch: \(C\% = \frac{{{m_{ct}}}}{{{m_{dd}}}}.100\%\)
- C% là nồng độ phần trăm của dung dịch.
- mct là khối lượng chất tan (gam)
- mdd là khối lượng dung dịch (gam) với (mdung dịch = mdung môi + mchất tan)
-
Các công thức suy ra từ công thức tính nồng độ phần trăm C%
-
Công thức tính khối lượng dung dịch là: \({m_{dd}} = \frac{{{m_{ct}}.100\% }}{{C\% }}\)
-
Công thức tính khối lượng chất tan: \({m_{ct}} = \frac{{C\% .{m_{dd}}}}{{100\% }}\)
-
b. Nồng độ mol của dung dịch
- Nồng độ mol (kí hiệu là CM) của dung dịch cho biết số mol chất tan có trong 1 lít dung dịch
- Công thức tính nồng độ mol của dung dịch: \({C_M} = \frac{n}{V}(mol/l)\)
-
n: số mol chất tan.
-
V: thể tích dung dịch.
-
- Các công thức được suy ra từ công thức nồng độ mol của dung dịch:
- Công thức tính số mol chất tan: \(n = {C_M}.V(mol)\)
- Công thức tính thể tích dung dịch: \(V = \frac{n}{{{C_M}}}(lit)\)
1.2. Kĩ năng thí nghiệm
- Chỉ được làm thí nghiệm khi có sự hiện diện của giáo viên trong phòng thí nghiệm.
- Đọc kỹ hướng dẫn và suy nghĩ trước khi làm thí nghiệm.
- Luôn luôn nhận biết nơi để các trang thiết bị an toàn.
- Phải mang kính bảo hộ.
- Phải cột tóc gọn lại.
- Làm sạch bàn thí nghiệm trước khi bắt đầu một thí nghiệm.
- Không bao giờ được nếm các hóa chất thí nghiệm. Không ăn hoặc uống trong phòng thí nghiệm.
- Không được nhìn xuống ống thí nghiệm.
- Nếu làm đổ hóa chất hoặc xảy ra tại nạn, báo cho giáo viên ngay lập tức.
- Rửa sạch da khi tiếp xúc với hóa chất.
- Nếu hóa chất rơi vào mắt, phải đi rửa mắt ngay lập tức.
- Bỏ chất thải thí nghiệm vào đúng nơi qui định như được hướng dẫn.
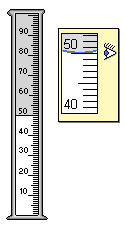
Lưu ý: Khi đong thể tích dung dịch bằng pipet, ống đong thì ta đong sao cho gợn trũng của giọt chất lỏng chạm vạch chia độ cần lấy và nhớ để mắt ngang với mực chất lỏng. Như trong hình vẽ là cách lấy chuẩn 50ml dung dịch chất lỏng. Tương tự khi thí nghiệm làm lấy số liệu ta cũng đọc số ml theo cách này.
Hình 1: Cách lấy chuẩn số ml dung dịch
2.1. Thực hành 1
Hãy tính toán và pha chế 50 gam dung dịch đường có nồng độ 15%.
a. Phần tính toán
Khối lượng chất tan (đường) cần dùng là:
\(C\% = \frac{{{m_{ct}}}}{{{m_{dd}}}}.100\% \Rightarrow {m_{ct}} = \frac{{C\% .{m_{dd}}}}{{100\% }} = \frac{{15\% .50}}{{100\% }} = 7,5(g)\)
Khối lượng nước cần dùng là:
mdung dịch = mdung môi + mchất tan ⇒ mdung môi = mdung dịch - mchất tan = 50- 7,5 = 42,5(g)
b. Phần thực hành
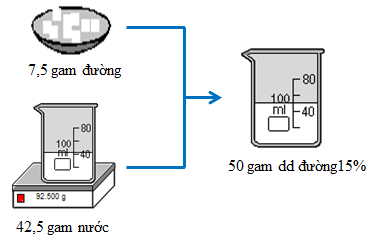
Cân 7,5g đường khan cho vào cốc có dung tích 100ml, khuấy đều với 42,5g nước, được dung dịch đường 15%.
(Em nào thắc mắc về con số 92,500 ghi ở cân thì quay lại xem cách cân dung dịch chất lỏng ở bài Pha chế dung dịch nhé)
Hình 1:Quá trình pha chế 50 gam dung dịch đường 15%
2.2. Thực hành 2
Hãy tính toán và pha chế dung dịch Natri clorua (NaCl) có nồng độ 0,2 M
a. Phần tính toán
Số mol chất tan (NaCl) cần dùng là:
\({n_{NaCl}} = {C_M}.V = 0,2.0,1 = 0,02(mol).\)
Khối lượng NaCl cần dùng là:
\({m_{NaCl}} = {n_{NaCl}}.{M_{NaCl}} = 0,02.(23 + 35,5) = 1,17(gam)\)
b. Phần thực hành
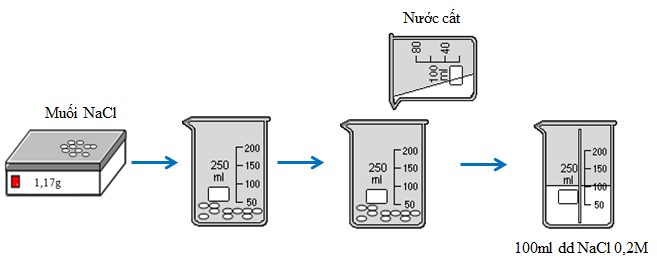
Cân 1,17g NaCl khan cho vào cốc chia độ. Rót từ từ nước vào cốc và khuấy đều cho đến vạch 100ml, được 100ml dung dịch NaCl 0,2M.
Hình 2: Quá trình pha chế 100ml dung dịch NaCl 0,2M
2.3. Thực hành 3
Hãy tính toán và pha chế dung dịch 50g dd đường 5% từ dd đường có nồng độ 15% ở phần thực hành 1.
a. Phần tính toán
Khối lượng chất tan (đường) có trong 50g dd đường 5% là:
\(C\% = \frac{{{m_{ct}}}}{{{m_{dd}}}}.100\% \Rightarrow {m_{ct}} = \frac{{C\% .{m_{dd}}}}{{100\% }} = \frac{{5\% .50}}{{100\% }} = 2,5(gam)\)
Khối lượng dd đường 15% có chứa 2,5g đường là:
\(C\% ' = \frac{{{m_{ct}}'}}{{{m_{dd}}'}}.100\% \Rightarrow {m_{dd}}' = \frac{{{m_{ct}}'.100\% }}{{C\% '}} = \frac{{2,5.100}}{{15}} \approx 16,7(gam)\)
Khối lượng nước cần dùng là:
mdung dịch = mdung môi + mchất tan ⇒ mdung môi = mdung dịch - mchất tan = 50- 16,7 = 33,3 (gam).
b. Phần thực hành
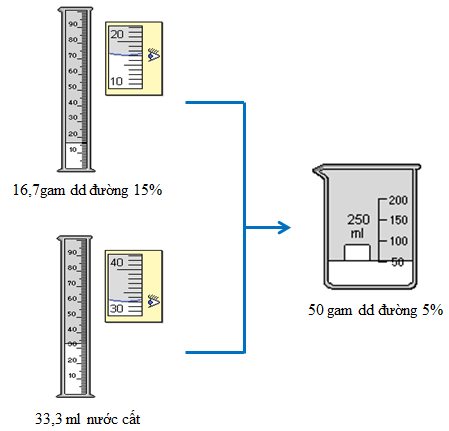
Cân 16,7g dd đường 15% cho vào cốc có dung tích 100ml. Thêm 33,3g nước (hoặc 33,3ml) vào cốc, khuấy đều, được 50g dd đường 5%.
Hình 3: Quá trình pha chế 50 gam dung dịch đường 5%
Lưu ý: Lấy dung dịch có thể sử dụng cân phân tích hoặc dùng ống đong để lấy lượng thể tích mong muốn.
2.4. Thực hành 4
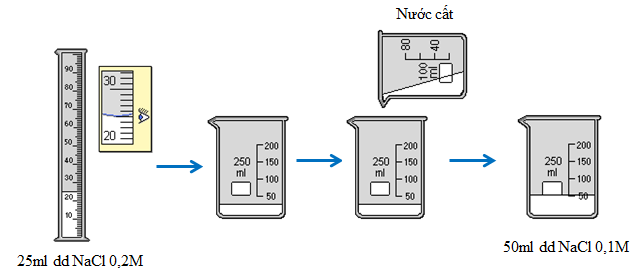
Hãy tính toán và pha chế dung dịch 50ml dd NaCl có nồng độ 0,1M từ dd NaCl có nồng độ 0,2M ở thực hành 2.
a. Phần tính toán
Số mol chất tan (NaCl) có trong 50ml dd 0,1M cần pha chế là:
\({n_{NaCl}} = {C_M}.V = 0,1.0,05 = 0,005(mol)\)
Thể tích dd NaCl 0,2M trong đó có chứa 0,005mol NaCl là:
\({C_M}' = \frac{n}{{V'}} \Rightarrow V' = \frac{n}{{{C_M}'}} = \frac{{0,005}}{{0,2}} = 0,025(l) = 25(ml)\)
b. Phần thực hành
Đong 25ml dd NaCl 0,2M cho vào cốc chia độ. Rót từ từ nước vào cốc đến vạch 50ml. Khuấy đều, được 50ml dd NaCl 0,1M.
Hình 4: Quá trình pha chế 50 ml dung dịch NaCl 0,1M
3. Hỏi đáp về Bài 45 Chương 6 Hóa học 8
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Copyright © 2021 HOCTAP247