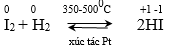Hoá học 10 Bài 25 Flo - Brom - Iot
Tóm tắt bài
1.1. Tính chất vật lí và trạng thái tự nhiên
- Flo:
- Khí màu lục nhạt, rất độc.
- Chỉ có ở dạng hợp chất.
- Brom:
- Chất lỏng màu đỏ nâu, dễ bay hơi, hơi brom độc.
- Chủ yếu tồn tại ở dạng hợp chất.
- Iot:
- Chất rắn, dạng tinh thể màu đen tím.
- Dễ thăng hoa.
- I2 (Rắn) → I2 (hơi) (Thăng hoa khi đun nóng)
- Chủ yếu ở dạng hợp chất
1.2. Tính chất hóa học
- Flo, brom, iot có tính oxi hóa mạnh.
- Tính oxi hóa giảm dần từ flo đến iot.
1.2.1. Tác dụng với kim loại
\(\begin{array}{l} 2\mathop M\limits^0 + n\mathop {{X_2}}\limits^0 \to 2\mathop M\limits^{ + n} \mathop {{X_n}}\limits^{ - 1} \\ Ca + {F_2} \to Ca{F_2}\\ 2Al + 3B{r_2} \to 2AlB{r_3}\\ 2Al + 3{I_2} \to 2Al{I_3}{\rm{ (xt: }}{{\rm{H}}_{\rm{2}}}{\rm{O}}) \end{array}\)
⇒ Tính oxi hóa giảm từ flo đến iot.
- Cách đọc tên muối halogen: Tên kim loại + Halohen + "ua"
- CaF2 (Canxi florua), AlBr3 (Nhôm Bromua), AlI3 (Nhôm Iotua)
1.2.2. Tác dụng với Hidro
- Tính axit và tính khử tăng theo chiều: HF
- Từ flo đến iot, bán kính nguyên tử tăng, liên kết giữa H và các halogen càng dài, liên kết càng kém bền, càng dễ phân li cho ion H+ nên tính axit và tính khử càng mạnh.
Flo
- Phương trình: F2 + H2 → 2HF
- Axit flohidric (HF) là axit yếu, ăn mòn các đồ vật bằng thủy tinh → dùng để khắc chữ hoặc vẽ hình lên thủy tinh.
SiO2 + 4HF → SiF4+2H2O (Silic tetraflorua)
- Lưu ý: không dùng lọ thủy tinh để đựng dung dịch HF.
Brom
- Phương trình: Br2 + H2 → 2HBr
-
Khí hidrobromua (HBr) tan trong nước tạo dung dịch axit bromhidric.
-
Khí hidro iotua tan nhiều trong nước tạo thành dung dịch axit iothidric.
Iot
- Phương trình:
1.2.3. Tác dụng với H2O
- Flo oxi hóa nước dễ dàng ở nhiệt độ thường.
- Từ phản ứng flo tác dụng mãnh liệt với nước → chứng tỏ rằng flo có tính oxi hóa mạnh hơn oxi và chứng tỏ rằng không điều chế được nước flo.
F2+ 2H2O→ 4HF + O2
→ không điều chế được nước flo.
-
Brom phản ứng với nước ở nhiệt độ thường, phản ứng chậm hơn so với clo tạo thành axit bromhidric và axit hipobromơ. Và là phản ứng thuận nghịch.
Br2 + H2O ⇔ HBr + HBrO (axit hipocloro)
- Iot không tác dụng với H2O
- Iot tác dụng với hồ tinh bột tạo thành dung dịch có màu xanh → dùng để nhận biết hồ tinh bột và ngược lại.
1.2.4. Tác dụng với muối
- Do tính oxi hóa giảm dần từ flo đến iot nên halogen có tính oxi hóa mạnh có thể đẩy halogen có tính oxi hóa yếu hơn ra khỏi dung dịch muối.
- Do flo có tính oxi hóa mạnh nhất nên không có chất hóa học nào có thể oxi hóa ion F- thành F2.
Cl2+2NaBr→2NaCl+Br2
Cl2 + 2NaI → 2NaCl + I2
Br2 + 2NaI → 2NaBr + I2
- Độ hoạt động hóa học: F> Cl> Br> I
1.3. Ứng dụng
- Flo
- Điều chế một số dẫn xuất hidrocacbon quan trọng chứa flo (floroten, chất dẻo teflon, chất CFC,…)
- Nhấn mạnh các hợp chất CFC làm suy giảm tầng ozon.
- Giáo dục môi trường.
- Brom: phương trình hóa học phân hủy của AgBr dưới tác dụng của ánh sáng → dùng trong công nghệ làm phim ảnh.
2AgBr → 2Ag + Br2 (Điều kiện: ánh sáng)
- Iot: bổ sung iot ( KI hoặc KIO3) bằng các sản phẩm như muối ăn, gia vị, nước mắm, sữa,…
1.4. Điều chế và sản xuất
- Điều chế Flo: Điện phân hỗn hợp KF và HF
2HF → H2 + F2 (Điều kiện: điện phân với xúc tác là KF)
- Điều chế Brom: Sản xuất từ nước biển
- Điều chế Iot: Sản xuất từ rong biển
Bài 1:
Trong các khẳng định sau, có mấy khẳng định đúng?
(1) Nhiệt độ sôi và nhiệt độ nóng chảy của các halogen tăng dần theo thứ tự F2, Cl2, Br2, I2.
(2) Muối iot là muối ăn có trộn lượng nhỏ KI hoặc I2.
(3) Cho khí clo đi qua dung dịch KOH đun nóng, lấy dung dịch thu được trộn với kali clorua và làm lạnh, ta sẽ thu được kali peclorat kết tinh.
(4) Khi cho F2 tác dụng với dung dịch NaOH loãng lạnh, xảy ra phản ứng tự oxi hóa, tự khử.
(5) Dung dịch NaF loãng được dùng làm thuốc chống sâu răng.
Hướng dẫn:
(1) Nhiệt độ sôi và nhiệt độ nóng chảy của các halogen tăng dần theo thứ tự F2, Cl2, Br2, I2 ⇒ Đúng.
(2) Muối iot là muối ăn có trộn lượng nhỏ KI hoặc I2 ⇒ Sai. Muối Iod trộn lượng nhỏ KIO3 hoặc KI.
(3) Cho khí clo đi qua dung dịch KOH đun nóng, lấy dung dịch thu được trộn với kali clorua và làm lạnh, ta sẽ thu được kali peclorat kết tinh ⇒ Sai. Thu được Kali clorat (KClO3) kết tinh.
(4) Khi cho F2 tác dụng với dung dịch NaOH loãng lạnh, xảy ra phản ứng tự oxi hóa, tự khử ⇒ Sai. Do Flo luôn có số oxi hóa (-1) trong mọi hợp chất nên không thể xảy ra phản úng tự oxi hóa tự khử được.
(5) Dung dịch NaF loãng được dùng làm thuốc chống sâu răng ⇒ Đúng.
⇒ Có 2 ý đúng.
Bài 2:
Cho 53,75 gam hỗn hợp X gồm kim loại Sn, Fe, Al tác dụng vừa đủ với 25,20 lít khí Cl2 (đktc). Mặt khác khi cho 0,40 mol hỗn hợp X tác dụng với dung dịch HCl nóng, dư thu được 9,92 lít khí H2 (đktc). Biết các phản ứng xảy ra hoàn toàn. Khối lượng của kim loại Al trong 0,40 mol hỗn hợp X có giá trị nào?
Hướng dẫn:
Trong 53,75g X có x mol Sn; y mol Fe; z mol Al
⇒ t(119x + 56y + 27z) = 53,75g
X + Cl2 → SnCl4; FeCl3; AlCl3
⇒ t(4x + 3y + 3z) = \(2n_{Cl_{2}}\) = 2,25 mol
(Trong 0,4 mol lượng chất gấp t lần)
⇒ 9(119x + 56y + 27z) = 215(4x + 3y + 3z)
⇒ 211x – 141y – 402z = 0(1)
⇒ x + y + z = 0,4 mol(2)
\(n_{H_{2}}=x+y+1,5z=\frac{31}{70} \ (mol) \ ^{(3)}\)
Từ (1,2,3) ⇒ z = 0,0857 mol
⇒ mAl = 2,314g
Bài 3:
Nung nóng 21,12 gam KMnO4 và 18,375 gam KClO3, sau một thời gian thu được chất rắn X gồm 6 chất có khối lượng 37,295 gam. Cho X tác dụng với dung dịch HCl đặc, dư, đun nóng. Toàn bộ lượng khí clo được cho phản ứng hết với m gam bột Fe đốt nóng được chất rắn Y. Hòa tan hoàn toàn Y vào nước được dung dịch Z. Thêm AgNO3 dư vào dung dịch Z đến khi phản ứng hoàn toàn được 204,6 gam kết tủa. Giá trị của m là?
Hướng dẫn:
Ta có: \(n_{KMnO_4}=0,14 \ mol;\ n_{KClO_3}=0,15\ mol\)
Bảo toàn khối lượng \(\rightarrow m_{O_2}=3,2 \ gam \rightarrow n_{O_2}=o,1 \ mol\)
Bảo toàn electron cho toàn bộ quá trình \(\rightarrow n_{Cl_2}=\frac{0,14\times 5+0,15\times 6-0,1\times 4}{2}=0,6 \ mol\)
Vì dung dịch AgNO3 dư → sau phản ứng hình thành Fe(NO3)3: x mol, Ag, AgCl.
Bảo toàn nguyên tố \(Cl\rightarrow n_{AgCl}=2n_{Cl_2}=1,2 \ mol\)
\(\rightarrow n_{Ag}=\frac{204,6-1,2\times 143,5}{108}=0,3 \ mol\)
\(\rightarrow n_{AgNO_3}=0,3+1,2=1,5 \ mol \rightarrow n_{Fe(NO_3)_3}=1,5:3=0,5 \ mol\) \(\rightarrow m=28 \ gam\)
3. Luyện tập Bài 25 Hóa học 10
Sau bài học cần nắm:
- Tính chất vật lí, trạng thái tự nhiên, ứng dụng và điều chế flo, brom, iot và một vài hợp chất của chúng.
- Tính chất hóa học cơ bản của flo, brom, iot là tính oxi hóa mạnh. Sự giống và khác nhau về tính chất của flo, brom, iot với clo. Flo có tính oxi hóa mạnh nhất.
- Nguyên nhân tính oxi hóa giảm dần từ flo đến iot. Nguyên nhân tính axit, tính khử tăng theo chiều: HF
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Flo - Brom - Iot có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. Mạnh hơn
- B. Yếu hơn
- C. Bằng nhau
- D. Cả A và C
-
- A. Mạnh hơn
- B. Yếu hơn
- C. Bằng nhau
- D. Cả B và C
-
- A. Tác dụng với Hidro
- B. Tác dụng với kim loại
- C. Tác dụng với hồ tinh bột
- D. Tác dụng với nước
-
- A. KI
- B. I2
- C. KIO3
- D. A hoặc C
-
- A. lỏng
- B. Lỏng sau đó thành hơi
- C. Rắn
- D. Thành hơi mà không thông qua trạng thái lỏng
Câu 3- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Flo - Brom - Iot.
Bài tập 2 trang 142 SGK Hóa học 10 nâng cao
Bài tập 3 trang 142 SGK Hóa học 10 nâng cao
Bài tập 4 trang 142 SGK Hóa học 10 nâng cao
Bài tập 5 trang 142 SGK Hóa học 10 nâng cao
Bài tập 6 trang 142 SGK Hóa học 10 nâng cao
Bài tập 7 trang 142 SGK Hóa học 10 nâng cao
Bài tập 1 trang 145 SGK Hóa học 10 nâng cao
Bài tập 2 trang 145 SGK Hóa học 10 nâng cao
Bài tập 3 trang 145 SGK Hóa học 10 nâng cao
Bài tập 4 trang 145 SGK Hóa học 10 nâng cao
Bài tập 5 trang 145 SGK Hóa học 10 nâng cao
Bài tập 6 trang 145 SGK Hóa học 10 nâng cao
4. Hỏi đáp về Bài 25 Chương 5 Hóa học 10
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Copyright © 2021 HOCTAP247