Hoá học 9 Bài 1: Tính chất hóa học của oxit và Khái quát về sự phân loại oxit
Tóm tắt bài
1.1. Tính chất hóa học của Oxit
1.1.1. Oxit bazơ có những tính chất hóa học nào?
Tác dụng được với nước
- Một số oxit bazơ tác dụng với nước ở nhiệt độ thường là : Na2O; CaO; K2O; BaO, …tạo ra bazơ tan (kiềm) tương ứng là: NaOH, Ca(OH)2 , KOH, Ba(OH)2, …
- Thí nghiệm CaO (vôi sống) tác dụng với nước
Video 1: CaO (vôi sống) tác dụng với nước
- Hiện tượng: vôi sống tan dần
- Giải thích: Do xảy ra phản ứng: CaO + H2O → Ca(OH)2
Tác dụng với axit
- Oxit bazơ tác dụng với axit tạo thành muối và nước. Oxit bazơ + axit → muối + nước
- Thí nghiệm: CuO tác dụng với dung dịch HCl
Video 2: Phản ứng giữa bột CuO và dung dịch HCl
- Hiện tượng: CuO tan dần tạo dung dịch màu xanh nước biển, khi cô cạn thu được muối màu xanh lơ
- Giải thích: CuO phản ứng với dung dịch HCl tạo muối CuCl2 ở trong dung dịch màu xanh, cô cạn có màu xanh lơ. CuO + 2HCl → CuCl2 + H2O
Tác dụng với Oxit axit
- Một số oxit bazơ (CaO, BaO, Na2O, K2O,…) tác dụng với oxit axit tạo thành muối.
- Oxit bazơ + oxit axit → muối
- ví dụ: ; \(N{a_2}O + C{O_2} \to N{a_2}C{O_3}\) ; CaO + CO2
CaCO3
1.1.2. Oxit axit có những tính chất nào?
Tác dụng với nước
- Oxit axit ngoài cách gọi tên như trên còn có cách gọi khác là: ANHIDRIC của axit tương ứng.
- Ví dụ: SO2: Anhidric sunfurơ (Axit tương ứng là H2SO3: axit sunfurơ)
- Nhiều oxit axit tác dụng với nước tạo thành dung dịch axit.
- Một số oxit axit tác dụng với nước ở điều kiện thường như: P2O5, SO2, SO3,NO2, N2O5, CO2 , CrO3… tạo ra axit tương ứng như: H3PO4, H2SO3, H2SO4, HNO3, H2CO3, H2Cr2O7, …
- Phương trình phản ứng:
- 2NO2 + H2O + 1/2O2 → 2HNO3.
- CO2 + H2O → H2CO3
Tác dụng với dung dịch bazơ
- Oxit axit tác dụng với dung dịch bazơ tạo thành muối và nước.
- Thí nghiệm: Khí CO2 tác dụng với dung dịch Ca(OH)2
Video 3: Khí CO2 làm vẩn đục dung dịch nước vôi trong
- Hiện tượng: Khi sục khí CO2 vào dung dịch nước vôi trong thấy kết tủa trắng.
- Giải thích: Do phản ứng CO2 + Ca(OH)2 → CaCO3 (kết tủa trắng) + H2O
Tác dụng với oxit bazơ
Oxit axit tác dụng với một số oxit bazơ (CaO, BaO, Na2O, K2O,…) tạo thành muối.
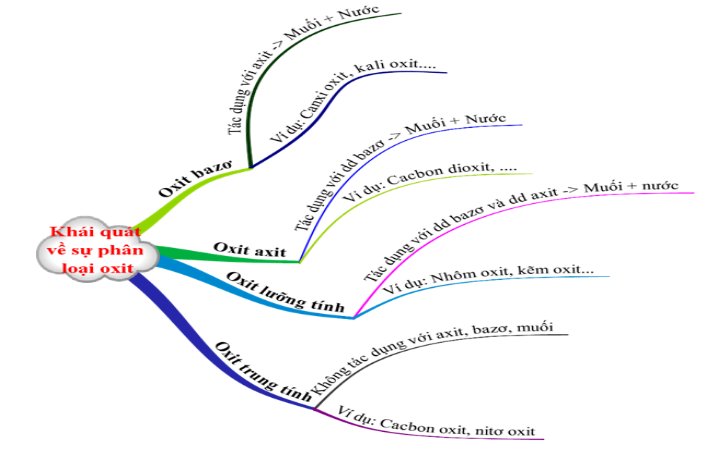
1.2. Khái quát về sự phân loại oxit
Các oxit được chia thành 4 loại
-
Oxit bazơ: Là những oxit khi tác dụng với dung dịch axit tạo thành muối và nước.
-
Ví dụ: Na2O , CuO , BaO, FeO ….
-
-
Oxit axit: Là những oxit khi tác dụng với dung dịch bazơ tạo thành muối và nước.
-
Ví dụ: SO2 ,SO3, CO2 , P2O5 …
-
-
Oxit lưỡng tính: Là những oxit khi tác dụng với dung dịch bazơ, và khi tác dụng với dung dịch axit tạo thành muối và nước.
-
Ví dụ: Al2O3 , ZnO , …
-
-
Oxit trung tính: Còn được gọi là oxit không tạo muối, là những oxit không tác dụng với axit, bazơ, muối.
-
Ví dụ: CO , NO …
-
Hình 1: Khái quát về sự phân loại Oxit
Bài 1:
Cho các chất khí sau đây:
Cacbon đioxit, hidro, oxi, lưu huỳnh đioxit, nitơ. Chọn chất phù hợp với mô tả.
a) Nặng hơn không khí
b) Nhẹ hơn không khí
c) Cháy được trong không khí
d) Tác dụng được với nước tạo thành dung dịch làm quỳ hóa đỏ
e) Làm đục nước vôi trong
f) Đổi màu quỳ ẩm từ tím sang đỏ
Hướng dẫn:
Cacbon đioxit (CO2) , hidro (H2), oxi (O2), lưu huỳnh đioxit (SO2), nitơ (N2)
a) Nặng hơn không khí là khí CO2 (44 > 29)
b) Nhẹ hơn không khí là H2, N2
c) Cháy được trong không khí là H2
d) Tác dụng được với nước tạo thành dung dịch làm quỳ hóa đỏ là SO2
e) Làm đục nước vôi trong là khí CO2
f) Đổi màu quỳ ẩm từ tím sang đỏ là khí SO2
Bài 2:
Cho các chất sau: Đồng(II) oxit,hidro,cacbon monooxit,lưu huỳnh trioxit,điphotpho pentaoxit,
nước. Chọn chất thích hợp điền vào dấu ba chấm.
\(\begin{array}{l} 1.{\rm{ }}...{\rm{ + }}{{\rm{H}}_{\rm{2}}}O{\rm{ }} \to {\rm{ }}{H_2}S{O_4}\\ 2.{\rm{ }}{{\rm{H}}_{\rm{2}}}O{\rm{ + }}...{\rm{ }} \to {\rm{ }}{{\rm{H}}_{\rm{3}}}P{O_4}\\ 3.{\rm{ }}...{\rm{ + HCl }} \to {\rm{ CuC}}{{\rm{l}}_{\rm{2}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}O\\ 4.{\rm{ }}...{\rm{ + }}{H_2}S{O_4}{\rm{ }} \to {\rm{ CuS}}{{\rm{O}}_{\rm{4}}} + {\rm{ }}... \end{array}\)
Hướng dẫn:
\(\begin{array}{l} 1.{\rm{ S}}{{\rm{O}}_3}{\rm{ + }}{{\rm{H}}_{\rm{2}}}O{\rm{ }} \to {\rm{ }}{H_2}S{O_4}\\ 2.{\rm{ 3}}{{\rm{H}}_{\rm{2}}}O{\rm{ + }}{{\rm{P}}_2}{{\rm{O}}_5}{\rm{ }} \to {\rm{ 2}}{{\rm{H}}_{\rm{3}}}P{O_4}\\ 3.{\rm{ Cu(OH}}{{\rm{)}}_2}{\rm{ + 2HCl }} \to {\rm{ CuC}}{{\rm{l}}_{\rm{2}}}{\rm{ + 2}}{{\rm{H}}_{\rm{2}}}O\\ 4.{\rm{ CuO + }}{H_2}S{O_4}{\rm{ }} \to {\rm{ CuS}}{{\rm{O}}_{\rm{4}}} + {{\rm{H}}_{\rm{2}}}O \end{array}\)
Bài 3:
Hòa tan 4,88 gam hỗn hợp A gồm MgO và FeO trong 200ml dung dịch H2SO4 0,45M (loãng) thì phản ứng vừa đủ, thu được dung dịch B.Tính khối lượng mỗi oxit có trong hỗn hợp A.
Hướng dẫn:
Vì phản ứng xảy ra vừa đủ nên hỗn hợp oxit kim loại và axit đều hết
Gọi số mol của MgO và FeO lần lượt là x và y
Phương trình phản ứng:
MgO + H2SO4 → MgSO4 + H2O
x → x
FeO+ H2SO4 → FeSO4 + H2O
y → y
Từ dữ kiện của bài toán ta có hệ phương trình:
\(\left\{ \begin{array}{l} 40x + 72y = 4,88\\ x + y = 0,45.0,2 = 0,09 \end{array} \right. \Rightarrow \left\{ \begin{array}{l} x = 0,05(mol)\\ y = 0,04(mol) \end{array} \right.\)
Khối lượng của MgO trong hỗn hợp là: mMgO = 0,05 . 40 = 2 (gam)
Khối lượng của FeO trong hỗn hợp là : mFeO = 4,88 - 2 = 2,88 (gam)
3. Luyện tập Bài 1 Hóa học 9
Sau bài học cần nắm:
- Tính chất hóa học của oxit
- Khái quát về sự phân loại oxit đi sâu tìm hiểu tính chất hóa học và giúp học sinh nắm bắt được cơ sở phân loại oxit.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 9 Bài 1 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
Câu 1:
Oxit là:
- A. Hỗn hợp của nguyên tố oxi với một nguyên tố hoá học khác
- B. Hợp chất của nguyên tố phi kim với một nguyên tố hoá học khác.
- C. Hợp chất của oxi với một nguyên tố hoá học khác
- D. Hợp chất của nguyên tố kim loại với một nguyên tố hoá học khác.
-
Câu 2:
Oxit lưỡng tính là:
- A. Những oxit tác dụng với dung dịch axit tạo thành muối và nước.
- B. Những oxit tác dụng với dung dịch bazơ và tác dụng với dung dịch axit tạo thành muối và nước.
- C. Những oxit tác dụng với dung dịch bazơ tạo thành muối và nước.
- D. Những oxit chỉ tác dụng được với muối.
-
- A. MgO
- B. P2O5
- C. K2O
- D. CaO
-
- A. CaO
- B. CO2
- C. CO
- D. NO
-
- A. CO2, SO3, Na2O,NO2
- B. CO2, SO2, H2O, P2O5
- C. SO2, P2O5, CO2, N2O5
- D. H2O, CaO, FeO, CuO
Câu 2- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 9 Bài 1.
Bài tập 2 trang 6 SGK Hóa học 9
Bài tập 3 trang 6 SGK Hóa học 9
Bài tập 4 trang 6 SGK Hóa học 9
Bài tập 5 trang 6 SGK Hóa học 9
Bài tập 6 trang 6 SGK Hóa học 9
Bài tập 1.1 trang 3 SBT Hóa học 9
Bài tập 1.2 trang 3 SBT Hóa học 9
Bài tập 1.3 trang 3 SBT Hóa học 9
Bài tập 1.4 trang 3 SBT Hóa học 9
Bài tập 1.5 trang 3 SBT Hóa học 9
Bài tập 1.6 trang 4 SBT Hóa học 9
Bài tập 1.7 trang 4 SBT Hóa học 9
4. Hỏi đáp về Bài 1 chương 1 Hóa học 9
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Copyright © 2021 HOCTAP247