Hoá học 9 Bài 5: Luyện tập Tính chất hóa học của oxit và axit
Tóm tắt bài
1.1. Tính chất hóa học của Oxit
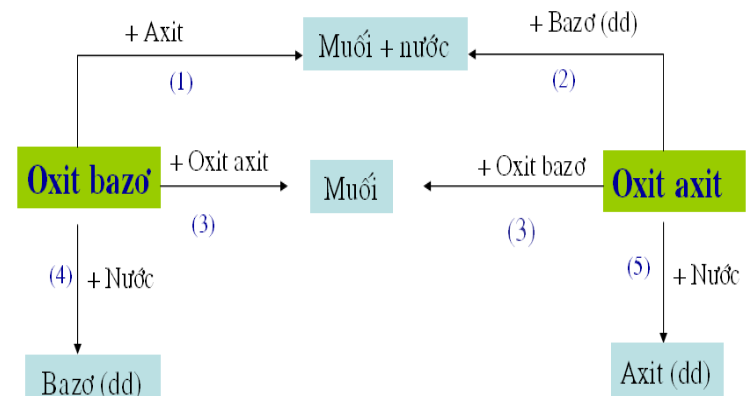
Hình 1: Mối liên hệ giữa oxit axit và oxit bazơ
Các phản ứng minh họa tính chất hóa học của Oxit
(1). CuO + 2HCl → CuCl2 + H2O
(2) .CO2 + Ca(OH)2 → CaCO3 + H2O
(3). CaO + CO2 → CaCO3
(4). Na2O + H2O → 2NaOH
(5). P2O5 + 3H2O → 2H3PO4
1.2. Tính chất hóa học của Axit
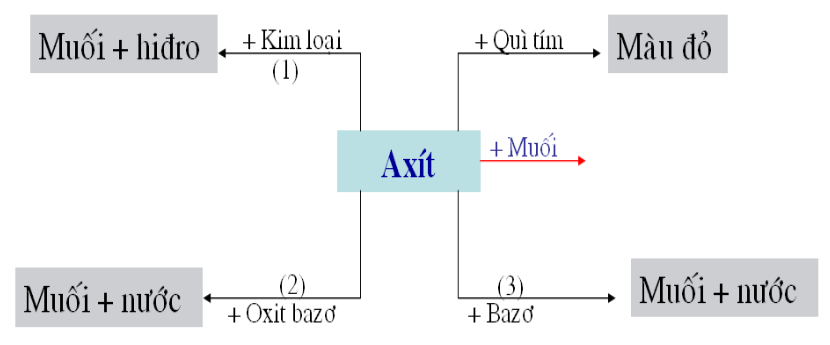
Hình 2: Tính chất hóa học của Axit
Các phản ứng minh họa tính chất hóa học của Axit
(1). 2HCl + Mg → MgCl2 + H2 .
(2). 3H2SO4 + Fe2O3 → Fe2(SO4)3 + 3H2O
(3). 3HCl + Fe(OH)3 → FeCl3+ 3H2O
1.3. Tổng kết
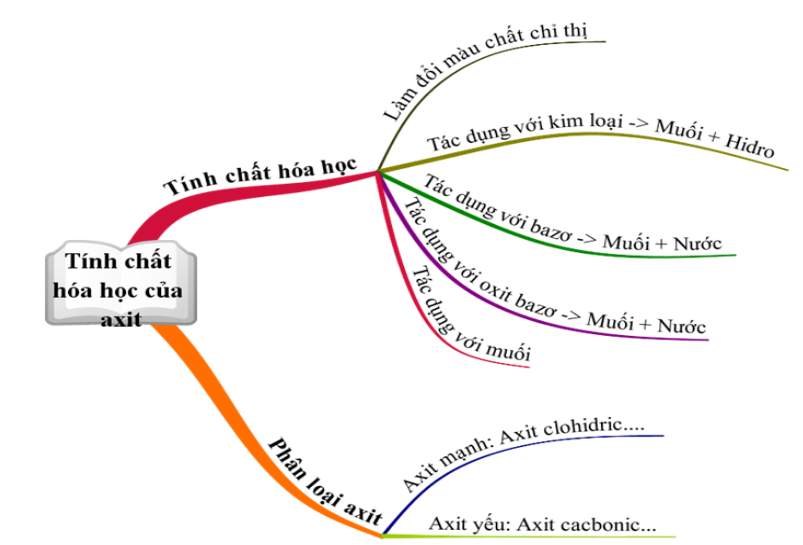
Hình 2: Sơ đồ tư duy bài luyện tập tính chất hóa học của Oxit
Hình 3: Tính chất hóa học của Axit
Bài 1:
Cho các chất sau : SO2, Fe2O3, K2O, BaO, P2O5 . Hãy cho biết những chất nào tác dụng được với:
a. Nước
b. Axit clohiđric
c. Kalihđroxit .
Hướng dẫn:
a. Những chất tác dung với nước là: SO2, K2O, BaO, P2O5 .
SO2 + H2O → H2SO3
K2O + H2O → 2KOH
BaO + H2O → Ba(OH)2
P2O5 +3H2O → 2H3PO4
b. Những chất tác dụng với HCl là: Fe2O3, K2O, BaO .
6HCl + Fe2O3 → 2FeCl3+ 3H2O
2HCl + K2O → 2KCl+ H2O
2HCl + BaO → BaCl2 + H2O
c. Những chất tác dụng với dd KOH: SO2, P2O5 .
2KOH + SO2 → K2SO3 + H2O
6KOH + P2O5 → 2K3PO4 + 3H2O
Bài 2:
Cho 1,12 lít khí CO2(đktc) tác dụng vừa hết với 100ml dung dịch Ba(OH)2, sản phẩm là BaCO3 và H2O.
- Viết phương trình hóa học xảy ra.
- Tính nồng độ mol của dung dịch Ba(OH)2 đã dùng.
- Tính khối lượng chất kết tủa thu được.
Hướng dẫn:
a. CO2 + Ba(OH)2 → BaCO3 + H2O
b. \({n_{C{O_2}}} = \frac{V}{{22,4}} = \frac{{1,12}}{{22,4}} = 0,05(mol)\)
CO2 + Ba(OH)2 → BaCO3 + H2O
1mol 1mol 1mol
0,05mol 0,05mol 0,05mol
\({C_M} = \frac{n}{V} = \frac{{0,05}}{{0,1}} = 0,5M\)
c. Khối lượng BaCO3 thu được:
\({m_{BaC{O_3}}} = n.M = 0,05.197 = 9,85(g)\)
Bài 3:
Lập công thức hóa học của một oxit kim loại hóa trị II biết rằng cứ 30ml dung dịch HCl nồng độ 14,6% thì hòa tan hết 4,8g oxit đó.
Hướng dẫn:
Đặt công thức hóa học của kim loại cần tìm là: RO.
Phương trình hóa học của phản ứng: RO + 2HCl → RCl2 + H2O
Số mol axit HCl: nHCl = 30.14,6100.36,5 = 0,12 mol
Số mol oxit : nRO = 0,12 : 2 = 0,06 mol
Khối lượng mol của oxit là 4,8 : 0,06 = 80g
Phân tử khối của oxit là RO = 80
Nguyên tử khối của R bằng: 80 – 16 = 64 đvc.
Bài 4:
Cho 14,5 gam hỗn hợp (Fe, Zn, Mg) tan hết trong H2SO4 loãng , thu được 6,72 lít khí (đktc) và dung dịch A.Cô cạn dung dịch A thu được m (gam) muối.
a) Tính m = ?
b) Tính V lít H2SO4 2M
Hướng dẫn:
a. Số mol khí H2 sinh ra là: \(n = \frac{V}{{22,4}} = \frac{{6,72}}{{22,4}} = 0,3(mol)\)
\({n_{{H_2}}} = {n_{{H_2}S{O_4}}} = 0,3(mol)\)
áp dụng định luật bảo toàn điện tích ta có:
mhỗn hợp kim loại + maxit = mmuối + mH2
⇔ 14,5 + 0,3.98 = m + 0,3.2
⇒ m = 43,3 (gam)
b. Thể tích H2SO4 đã dùng là:
\({C_M} = \frac{n}{V} \Rightarrow V = \frac{n}{{{C_M}}} = \frac{{0,3}}{2} = 0,15(lit)\)
3. Luyện tập Bài 5 Hóa học 9
Sau bài học cần nắm: tính chất hóa học của hai nhóm chất cơ bản của hóa học vô cơ là Oxit và Axit.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 9 Bài 5 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. Lượng H2 thoát ra từ sắt nhiều hơn kẽm.
- B. Lượng H2 thoát ra từ kẽm nhiều hơn sắt.
- C. Lượng H2 thu được từ sắt và kẽm như nhau.
- D. Lượng H2 thoát ra từ sắt gấp 2 lần lượng H2 thoát ra từ kẽm.
-
- A. Phản ứng trung hoà
- B. Phản ứng thế.
- C. Phản ứng hoá hợp
- D. Phản ứng oxi hoá – khử.
-
- A. Quì tím, dung dịch NaCl
- B. Quì tím, dung dịch NaNO3.
- C. Quì tím, dung dịch Na2SO4
- D. Quì tím, dung dịch BaCl2
-
- A. 5.
- B. 6.
- C. 7.
- D. 8.
-
- A. Sủi bọt khí, đá vôi không tan
- B. Đá vôi tan dần, không sủi bọt khí.
- C. Không sủi bọt khí, đá vôi không tan
- D. Sủi bọt khí, đá vôi tan dần.
Câu 2- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 9 Bài 5.
Bài tập 1 trang 21 SGK Hóa học 9
Bài tập 2 trang 21 SGK Hóa học 9
Bài tập 3 trang 21 SGK Hóa học 9
Bài tập 4 trang 21 SGK Hóa học 9
Bài tập 5 trang 21 SGK Hóa học 9
Bài tập 5.1 trang 7 SBT Hóa học 9
Bài tập 5.2 trang 8 SBT Hóa học 9
Bài tập 5.3 trang 8 SBT Hóa học 9
Bài tập 5.4 trang 8 SBT Hóa học 9
Bài tập 5.5 trang 8 SBT Hóa học 9
Bài tập 5.6 trang 8 SBT Hóa học 9
Bài tập 5.7 trang 8 SBT Hóa học 9
4. Hỏi đáp về Bài 5 chương 1 Hóa học 9
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Copyright © 2021 HOCTAP247