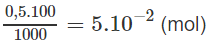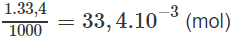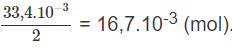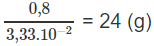Trang chủ
Đề thi & kiểm tra
Lớp 11
Hóa học
Giải SBT Hóa học 11 Bài 4: Phản ứng trao đổi ion trong dung dịch các chất điện li !!
Hòa tan hoàn toàn 0,8 g một kim loại hoá...
Hòa tan hoàn toàn 0,8 g một kim loại hoá trị II hoà tan hoàn toàn trong 100 ml H2SO4 0,5 M
Câu hỏi :
Hòa tan hoàn toàn 0,8 g một kim loại hoá trị II trong 100 ml 0,5 M. Lượng axit còn dư phản ứng vừa đủ với 33,4 ml dung dịch NaOH 1,00 M. Xác định tên kim loại.
* Đáp án
* Hướng dẫn giải
Số mol trong 100ml dung dịch 0,5M là :
Số mol NaOH trong 33,4 ml nồng độ 1M :
+ 2NaOH → + 2
Lượng đã phản ứng với NaOH :
Số mol đã phản ứng với kim loại là :
5. - 1.67. = 3,33. mol
Dung dịch 0,5M là dung dịch loãng nên :
X + → + ↑
Số mol X và số mol phản ứng bằng nhau, nên :
3,33. mol X có khối lượng 0,8 g
1 mol X có khối lượng:
⇒ Mkim loại = 24 g/mol.
Vậy kim loại hoá trị II là magie.
Câu hỏi trên thuộc đề trắc nghiệm dưới đây !
Giải SBT Hóa học 11 Bài 4: Phản ứng trao đổi ion trong dung dịch các chất điện li !!
Số câu hỏi: 13
Copyright © 2021 HOCTAP247