Dung dịch X chứa 0,05 mol NO3-; 0,03 mol Al3+; 0,02 mol Fe3+; x mol Cu2+và y mol SO42-. Cho X tác dụng hết với dung dịch BaCl2dư, thu được 13,98 gam kết tủa. Mặt khác, cho V ml dun...
Câu hỏi :
Dung dịch X chứa 0,05 mol NO3-; 0,03 mol Al3+; 0,02 mol Fe3+; x mol Cu2+và y mol SO42-. Cho X tác dụng hết với dung dịch BaCl2dư, thu được 13,98 gam kết tủa. Mặt khác, cho V ml dung dịch NaOH 0,3M vào X, thu được 4,68 gam kết tủa. Biết các phản ứng đều xảy ra hoàn toàn. Giá trị của V là
A. 300 ml.
B. 500 ml.
C. 600 ml.
D. 566,7 ml.
* Đáp án
C
* Hướng dẫn giải
Đáp án C
Áp dụng định luật bảo toàn điện tích cho dung dịch X có:
0,05 + 2y = 0,03.3 + 0,02. 3 + 2x
y-x = 0,05
Cho X + BaCl2 dư 13,98g kết tủa
⇒Kết tủa là BaSO4: 0,06 mol
Ba2++ SO42- BaSO4
0,06 0,06 (mol)
y= 0,06 mol x=0,01
Khi cho X + NaOH :
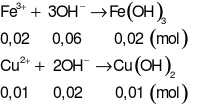
Khối lượng kết tủa Fe(OH)3và Cu(OH)2 là m = 3,12g< kết tủa thu được.
Vậy trong kết tủa thực tế thu được có Al(OH)3(4,68 - 3,12= 1,56g)
Số mol Al(OH)3 có trong kết tủa = 0,02 mol
Al3++ 3OH-Al(OH)3
0,030,090,03 (mol)
Số mol Al(OH)3sinh ra là 0,03 mol nhưng kết tủa thu được chỉ còn 0,02 mol 0,01 mol bị hoà tan bởi NaOH dư.
Al(OH)3 + OH- AlO2- + H2O
0,01 0,01
Vậy tổng số mol OH-tham gia phản ứng với dung dịch X là:
n = 0,06 + 0,02 + 0,09 + 0,01= 0,18 (mol) = nNaOH
Vậy VNaOH=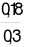 = 0,6 (l) = 600ml.
= 0,6 (l) = 600ml.
Câu hỏi trên thuộc đề trắc nghiệm dưới đây !
Đề thi Hóa 11 giữa kì 1 có đáp án !!
Copyright © 2021 HOCTAP247
