Tính % khối lượng dựa vào sơ đồ phản ứng?
Câu hỏi :
Hòa tan 10,92 gam hỗn hợp X chứa Al, Al2O3 và Al(NO3)3 vào dung dịch chứa NaHSO4 và 0,09 mol HNO3, khuấy đều cho các phản ứng xảy ra hoàn toàn, thu được dung dịch Y chứa các chất tan có khối lượng 127,88 gam và 0,08 mol hỗn hợp khí Z gồm 3 khí không màu, không hóa nâu ngoài không khí. Tỉ khối hơi của Z so với He bằng 5. Cho từ từ đến dư dung dịch NaOH vào dung dịch Y, phản ứng được biểu diễn theo đồ thị sau: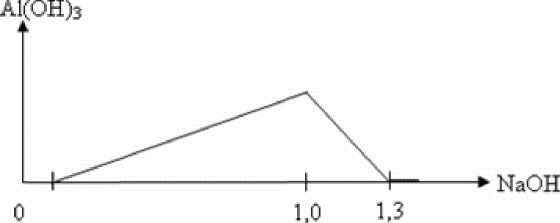
A. 41,25%.
B. 68,75%.
C. 55,00%.
D. 82,50%.
* Đáp án
B
* Hướng dẫn giải
gt ⇒ Z gồm N2O, N2, H2 ⇒ Y không chứa NO3–; khí có PTK lớn nhất trong Z là N2O.
\(\underbrace {\left\{ \begin{array}{l}
Al\\
A{l_2}{O_3}\\
Al{\left( {N{O_3}} \right)_3}
\end{array} \right\}}_{10,92\left( g \right)} + \left\{ \begin{array}{l}
NaHS{O_4}\\
HN{O_3}:0,09
\end{array} \right\} \to \left\{ \begin{array}{l}
{N_2}O\\
{N_2}\\
{H_2}
\end{array} \right\} + {H_2}O + \left\{ \begin{array}{l}
A{l^{3 + }}\\
N{a^ + }\\
NH_4^ + \\
{H^ + }\\
SO_4^{2 - }
\end{array} \right\}\)
Từ 1 mol NaOH đến 1,3 mol NaOH thì kết tủa từ cực đại đến tan hết do xảy ra phản ứng:
Al(OH)3 + NaOH → NaAlO2 + 2H2O ⇒ nAl3+ = nAl(OH)3 = 1,3 - 1 = 0,3 mol.
Đặt nNaHSO4 = x ⇒ nNa+/Y = nSO42– = x. Khi kết tủa đạt cực đại thì chỉ thu được Na2SO4.
⇒ nNa2SO4 = x ⇒ ∑nNa+ = 2x ⇒ nNa+/Y = 2x - 1 = x ⇒ x = 1.
Đặt nNH4+ = y; nH+ = z. Bảo toàn điện tích: 0,3 × 3 + 1 + y + z = 1 × 2
mmuối = 127,88(g) = 0,3 × 27 + 1 × 23 + 18y + z + 1 × 96
Giải hệ có: y = 0,04 mol; z = 0,06 mol. Bảo toàn khối lượng:
mH2O = 10,92 + 1 × 120 + 0,09 × 63 - 127,88 - 0,08 × 20 = 7,11g ⇒ nH2O = 0,395 mol.
Bảo toàn nguyên tố Hidro: nH2 = (1 + 0,09 - 0,04 × 4 - 0,06 - 0,395 × 2)/2 = 0,04 mol.
Đặt nN2O = a; nN2 = b ⇒ nZ = a + b + 0,04 = 0,08; mZ = 44a + 28b + 0,04 × 2 = 0,08 × 20
Giải hệ có: a = 0,025 mol; b = 0,015 mol ⇒ %mN2O = 0,025 × 44 ÷ 1,6 × 100% = 68,75%.
Câu hỏi trên thuộc đề trắc nghiệm dưới đây !
Đề thi thử THPT QG năm 2020 môn Hóa lần 1 Trường THPT Bình Độ
Copyright © 2021 HOCTAP247
