Đốt cháy hoàn toàn 1,88 gam chất hữu cơ A (chứa C, H, O) cần 1,904
Câu hỏi :
Đốt cháy hoàn toàn 1,88 gam chất hữu cơ A (chứa C, H, O) cần 1,904 lít O2 (đktc) thu được CO2 và hơi nước theo tỉ lệ thể tích 4:3. Hãy xác định công thức phân tử của A. Biết tỉ khối của A so với không khí nhỏ hơn 7.
A. C8H12O5.
B. C4H8O2.
C. C8H42O3.
D. C6H12O6.
* Đáp án
A
* Hướng dẫn giải
Thông thường khi đề bài cho số mol O2 cần để đốt cháy thì chắc chắn ta sẽ phải sử dụng hoặc định luật bảo khối lượng, hoặc bảo toàn nguyên tố Oxi.
Quay trở lại bài toán này, ta thấy đề cho cần dùng 1,904 lít O2, không cho khối lượng CO2 và H2O mà chỉ cho tỉ lệ thể tích (tỉ lệ số mol), do đó nhận ra được nếu ta sử dụng phương pháp bảo toàn khối lượng ta sẽ tính được số mol CO2 và số mol H2O, từ đó tính được số mol O trong A. Tiếp theo đó ta sẽ xác định công thức đơn giản nhất để tìm ra công thức phân tử.
Có:
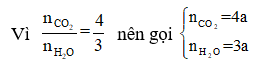
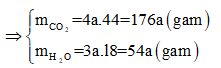
Sơ đồ phản ứng: A + O2 ⇒ CO2 + H2O
Áp dụng định luật bảo toàn khối lượng ta có:
Hay 1,88 + 2,72 = 176a + 54a ⟺ a = 0,02
⇒ 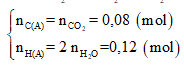
![]()
![]()
Vì C : H : O = nC : nH : nO =0,08 : 0,12 : 0,05 = 8 : 12 : 5
Nên công thức đơn giản nhất của A là C8H12O5.
Khi đó công thức phân tử của A có dạng (C8H12O5)n
Mà MA < 7Mkhôngkhí nên 188n < 7.29 ⇒ n < 1,08 ⇒ n = l
Do đó công thức phân tử của A là C8H12O5.
Đáp án A.
Câu hỏi trên thuộc đề trắc nghiệm dưới đây !
Bài tập Phương pháp bảo toàn khối lượng cực hay có giải chi tiết !!
Copyright © 2021 HOCTAP247
