Hoá học 9 Bài 44 Rượu etylic
Tóm tắt bài
Rượu Etylic:
Công thức phân tử: C2H5OH
Nguyên tử khối: 46
1.1. Tính chất vật lí của Rượu Etylic
a) Khái niệm
-
Rượu Etylic là chất lỏng không màu, nhẹ hơn nước.
-
Sôi ở 78,3oC.
-
Nhẹ hơn nước và tan vô hạn trong nước. Rượu Etylic hòa tan được nhiều chất như iot, benzen…
b) Độ rượu là gì? Cách tính độ rượu.
-
Độ rượu là số ml rượu Etylic nguyên chất có trong 100ml hỗn hợp rượu Etylic với nước.
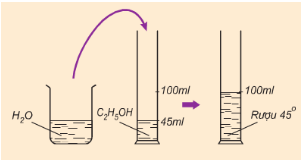
Hình 1: Cách pha chế rượu 450
1.2. Cấu tạo phân tử của Rượu etylic
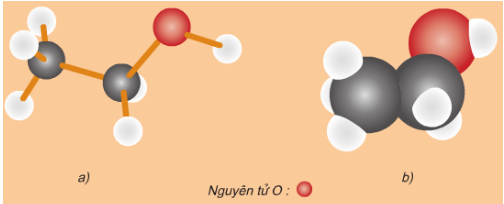
Hình 2: Mô hình phân tử rượu etylic
a)Dạng rỗng; b)Dạng đặc
- Rượu Etylic có công thức cấu tạo thu gọn là CH3 – CH2 – OH
- Trong phân tử rượu Etylic có một nguyên tử Hidro không liên kết với nguyên tử Cacbon mà liên kết với nguyên tử Oxi tạo ra nhóm – OH. Chính nhóm – OH này làm cho rượu có tính chất hóa học đặc trưng.
1.3. Tính chất hóa học của Rượu etylic
a) Rượu etylic có cháy không?
- Cách tiến hành: Các em chú ý quan sát thí nghiệm sau đây
Video 1: Rượu etylic cháy với Oxi
- Hiện tượng: Rượu etylic cháy với ngọn lửa màu xanh, tỏa nhiều nhiệt.
- Giải thích: Rượu etylic tác dụng với oxi khi đun nóng theo phương trình C2H6O(l) + 3O2(k) → 2CO2(k) + 3H2O(h)
b) Rượu etylic có tác dụng với Natri không?
- Cách tiến hành: Các em chú ý quan sát thí nghiệm sau
Video 2: Rượu etylic tác dụng với Natri
- Hiện tượng: Mẩu natri tan dần và có bọt khí thoát ra
- Giải thích: Natri phản ứng với rượu etylic giải phóng khí H2 theo phương trình 2CH3-CH2-OH + 2Na → 2CH3-CH2-ONa + H2
c) Phản ứng với Axit axetic
- Cách tiến hành: Các em chú ý quan sát thí nghiệm sau
Video 3: Rượu etylic tác dụng với Axit axetic
- Hiện tượng: Trong ống nghiệm có chất lỏng không màu, mùi thơm, không tan trong nước, nổi trên mặt nước.
- Giải thích: Rượu etylic tác dụng với axit axetic tạo etyl axetat theo phản ứng C2H5OH + CH3COOH
CH3COOC2H5 + H2O
1.4. Ứng dụng của Rượu etylic
Hình 3: Ứng dụng của Rượu etylic
1.5. Điều chế rượu etylic
- Phương pháp 1: Tinh bột hoặc đường \(\overset{len men}{\rightarrow}\) rượu Etylic
Hình 4: Quy trình chế rượu etylic bằng phương pháp lên men rượu
- Phương pháp 2: C2H4(k) + H2O(l) \(\overset{Axit}{\rightarrow}\) C2H5OH
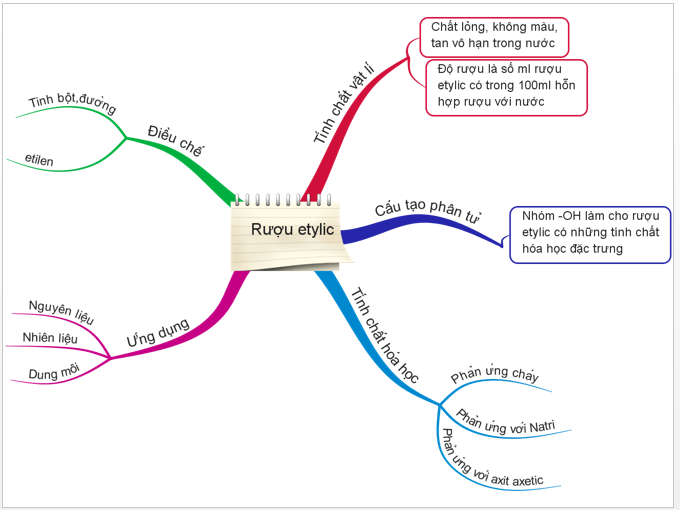
1.6. Tổng kết
Hình 5: Sơ đồ tư duy bài Rượu Etylic
Bài 1:
Cho 11,2 lít khí etilen ( đktc) tác dụng với nước có axit sunfuric (H2SO4) làm xúc tác, thu được 9,2 gam rượu etylic. Hiệu suất phản ứng là:
Hướng dẫn:
Số mol khí etilen là: \({n_{{C_2}{H_4}}} = \frac{{11,2}}{{22,4}} = 0,5(mol)\)
Phương trình phản ứng: C2H4(k) + H2O(l) \(\overset{Axit}{\rightarrow}\) C2H5OH
0,5 → 0,5
Khối lượng rượu etylic thu được theo lí thuyết là: m = 0,5.46 = 23 gam
Đề bài cho khối lượng rượu etylic thu được thực tế là 9,2 gam
Hiệu suất phản ứng là: \(H = \frac{{{m_{tt}}}}{{{m_{lt}}}}.100 = \frac{{9,2}}{{23}}.100 = 40\%\)
Bài 2:
Đốt cháy hoàn toàn 12 ml rượu etylic chưa rõ nồng độ. Cho toàn bộ sản phẩm vô nước vôi trong dư người ta thu được 40 gam kết tủa. Xác định độ rượu biết khối lượng riêng của Rượu etylic là 0,8 gam/ml.
Hướng dẫn:
Cách 1:
Ta có: \({n_{CaC{O_3}}} = \frac{{40}}{{100}} = 0,4(mol)\)
Phương trình phản ứng là:
C2H5OH + 3O2 → 2CO2 + 3H2O (1)
0,2 \(\leftarrow\) 0,4
CO2 + Ca(OH)2 → CaCO3\(\downarrow\) + H2O (2)
0,4 \(\leftarrow\) 0,4
Khối lượng của rượu etylic là: \({m_{{C_2}{H_5}OH}} = 0,2.46 = 9,2(gam)\)
Ta có: m = D.V ⇒ \(V = \frac{m}{D} = \frac{{9,2}}{{0,8}} = 11,5(ml)\)
Vậy độ rượu là: \(\frac{{11,5}}{{12}}.100 = {96^0}\)
Cách 2:
Ta có: \({n_{CaC{O_3}}} = \frac{{40}}{{100}} = 0,4(mol)\)
Bảo toàn nguyên tố Cacbon theo sơ đồ phản ứng như sau:
C2H5OH → 2CO2 → 2CaCO3
0,2 \(\leftarrow\) 0,4
Khối lượng của rượu etylic là: \({m_{{C_2}{H_5}OH}} = 0,2.46 = 9,2(gam)\)
Ta có: m = D.V ⇒ \(V = \frac{m}{D} = \frac{{9,2}}{{0,8}} = 11,5(ml)\)
Vậy độ rượu là: \(\frac{{11,5}}{{12}}.100 = {96^0}\)
Bài 3:
Cần bao nhiêu thể tích rượu nguyên chất cho vào 60 ml dung dịch rượu 400 thành rượu 600
Hướng dẫn:
Chất tan thay đổi ,dung dịch thay đổi , nồng độ thay đổi.
Thể tích rượu nguyên chất trong dung dịch lúc đầu là:
Độ rượu = \(\frac{{{V_{ruou{\rm{ nguyen chat}}}}}}{{{V_{dd}}}}.100\) ⇒ VRượu nguyên chất = (Độ rượu.Vdd)/100 = \(\frac{{40.60}}{{100}} = 24(ml)\)
Thể tích dung dịch rượu nguyên chất sau khi pha là 24 + x (ml)
Thể tích dung dịch rượu lúc sau là: 60 + x (ml)
Thay vào công thức tính độ rượu lúc sau ta có:
\(60 = \frac{{24 + x}}{{60 + x}}.100 \Rightarrow x = 30(ml)\)
Vậy nếu ta thêm 30 ml rượu nguyên chất vào 60 ml rượu 400 thì sẽ thành rượu 600.
3. Luyện tập Bài 44 Hóa học 9
Sau bài học cần nắm:
- Rượu etylic có công thức cấu tạo như thế nào?
- Nó có những tính chất và ứng dụng ra sao?
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 9 Bài 44 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
Câu 1:
Độ rượu là:
- A. số ml rượu etylic có trong 100 ml hỗn hợp rượu với nước.
- B. số ml nước có trong 100 ml hỗn hợp rượu với nước.
- C. số gam rượu etylic có trong 100 ml hỗn hợp rượu với nước.
- D. số gam nước có trong 100 gam hỗn hợp rượu với nước.
-
- A. 45 ml nước và 55 ml rượu nguyên chất.
- B. 45 ml rượu nguyên chất và 55 ml nước.
- C. 45 gam rượu nguyên chất và 55 gam nước.
- D. 45 gam nước và 55 gam rượu nguyên chất.
-
- A. CH2 – CH3 – OH.
- B. CH3 – O – CH3.
- C. CH2 – CH2 – OH2.
- D. CH3 – CH2 – OH.
-
Câu 4:
Rượu etylic là:
- A. chất lỏng không màu, nhẹ hơn nước, tan vô hạn trong nước, hòa tan được nhiều chất như iot, benzen,…
- B. chất lỏng màu hồng , nhẹ hơn nước, tan vô hạn trong nước, hòa tan được nhiều chất như: iot, benzen,…
- C. chất lỏng không màu, không tan trong nước, hòa tan được nhiều chất như: iot, benzen,…
- D. chất lỏng không màu, nặng hơn nước, tan vô hạn trong nước, hòa tan được nhiều chất như: iot, benzen,…
-
- A. 100 ml nước hòa với có 65 ml rượu nguyên chất.
- B. 100 ml rượu etylic nguyên chất có 65 ml nước
- C. 65 ml rượu etylic nguyên chất hòa với 35 ml nước.
- D. 35 ml rượu nguyên chất với 65 ml nước.
Câu 3- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 9 Bài 44.
Bài tập 1 trang 139 SGK Hóa học 9
Bài tập 2 trang 139 SGK Hóa học 9
Bài tập 3 trang 139 SGK Hóa học 9
Bài tập 4 trang 139 SGK Hóa học 9
Bài tập 5 trang 139 SGK Hóa học 9
Bài tập 44.1 trang 53 SBT Hóa học 9
Bài tập 44.2 trang 53 SBT Hóa học 9
Bài tập 44.3 trang 53 SBT Hóa học 9
Bài tập 44.4 trang 53 SBT Hóa học 9
Bài tập 44.5 trang 53 SBT Hóa học 9
Bài tập 44.6 trang 54 SBT Hóa học 9
Bài tập 44.7 trang 54 SBT Hóa học 9
4. Hỏi đáp về Bài 44 chương 5 Hóa học 9
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Copyright © 2021 HOCTAP247