Hoá học 9 Bài 51: Saccarozơ
Tóm tắt bài
Saccarozơ
Công thức phân tử: C12H22O11
Nguyên tử khối: 342
1.1. Trạng thái tự nhiên
Hình 1: Saccarozơ chứa nhiều trong mía, củ cải đường, thốt nốt
1.2. Tính chất vật lí
Là chất kết tinh, không màu, vị ngọt, tan nhiều trong nước đậc biệt là trong nước nóng
1.3. Tính chất hóa học
Bản thân Saccarozơ không có phản ứng tráng gương nhưng do phản ứng thủy phân sinh ra Glucozơ mà Glucozơ lại có phản ứng thủy phân.
- Các em chú ý quan sát cách tiến hành trong thí nghiệm sau đây:
Video 1: Sự thủy phân của Saccarozơ
- Hiện tượng: Có xuất hiện kết tủa màu trắng sáng bám lên thành ống nghiệm.
- Giải thích:
Đầu tiên trong ống nghiệm diễn ra sự thủy phân Saccarozơ tạo Glucozơ và Fructozơ
C12H22O11 + H2O \(\xrightarrow[t^{0}]{Axit}\) C6H12O6 + C6H12O6
(Saccarozơ) (Glucozơ) (Fructozơ)
Để chứng minh sản phẩm sau thủy phân có chứa Glucozơ người ta tiến hành cho dung dịch vào AgNO3 trong amoniac có xuất hiện kết tủa Ag màu trắng sáng.
C6H12O6 + Ag2O \(\overset{NH_{3}}{\rightarrow}\) C6H12O7 (Axit gluconic) + 2Ag\(\downarrow\)
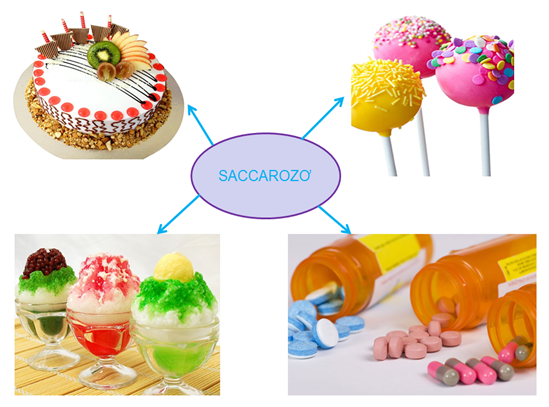
1.4. Ứng dụng của Saccarozơ
Hình 2: Ứng dụng của Saccarozơ
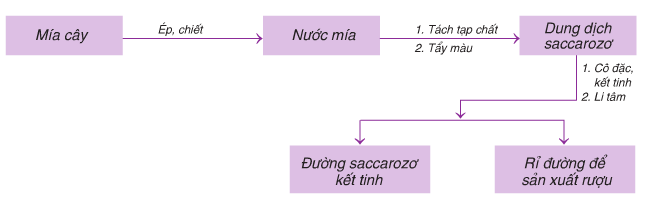
Hình 3: Quy trình sản xuất Saccarozơ từ mía
Bài 1:
Thủy phân hoàn toàn 171 g dung dịch saccarozơ 20% trong môi trường axit (vừa đủ) được dd X. Cho dd AgNO3 trong NH3 vào X đun nhẹ được m gam Ag. Giá trị của m là bao nhiêu?
Hướng dẫn:
Khối lượng Saccarozơ đem thủy phân là:
\(C\% = \frac{{{m_{ct}}}}{{{m_{dd}}}}.100 \Rightarrow {m_{ct}} = \frac{{C\% .{m_{dd}}}}{{100}} = \frac{{20.171}}{{100}} = 34,2(gam)\)
Số mol Saccarozơ đem thủy phân là:
\({n_{{C_{12}}{H_{22}}{O_{11}}}} = \frac{m}{M} = \frac{{34,2}}{{342}} = 0.1(mol)\)
C12H22O11 + H2O \(\xrightarrow[t^{0}]{Axit}\) C6H12O6 (Glucozơ) + C6H12O6 (Fructozơ không tráng gương)
0,1 \(\leftarrow\) 0,1 (mol)
C6H12O6 + Ag2O \(\overset{NH_{3}}{\rightarrow}\) C6H12O7 (Axit gluconic) + 2Ag\(\downarrow\)
0,1(mol) \(\leftarrow\) 0,2(mol)
Khối lượng kết tủa Bạc thu được là: \({m_{Ag}} = {n_{Ag}}.{M_{Ag}} = 0,2.108 = 21,6(gam)\)
3. Luyện tập Bài 51 Hóa học 9
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 9 Bài 51 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. nguyên liệu trong công nghiệp thực phẩm, thức ăn cho người, pha chế thuốc.
- B. nguyên liệu sản xuất thuốc nhuộm, sản xuất giấy, là thức ăn cho người.
- C. làm thức ăn cho người, tráng gương , tráng ruột phích.
- D. làm thức ăn cho người, sản xuất gỗ, giấy, thuốc nhuộm.
-
- A. Dung dịch H2SO4 loãng.
- B. Dung dịch NaOH.
- C. Dung dịch AgNO3 /NH3.
- D. Na kim loại.
-
- A. H2 (xúc tác Ni, t0).
- B. dung dịch AgNO3/NH3.
- C. Cu(OH)2
- D. dung dịch NaOH.
-
- A. 2778,75 gam
- B. 2697,5 gam.
- C. 2877,75 gam.
- D. 2967,5 gam.
Câu 3- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 9 Bài 51.
Bài tập 1 trang 155 SGK Hóa học 9
Bài tập 2 trang 155 SGK Hóa học 9
Bài tập 3 trang 155 SGK Hóa học 9
Bài tập 4 trang 155 SGK Hóa học 9
Bài tập 5 trang 155 SGK Hóa học 9
Bài tập 6 trang 155 SGK Hóa học 9
Bài tập 51.1 trang 59 SBT Hóa học 9
Bài tập 51.2 trang 59 SBT Hóa học 9
Bài tập 51.3 trang 59 SBT Hóa học 9
Bài tập 51.4 trang 60 SBT Hóa học 9
4. Hỏi đáp về Bài 51 chương 5 Hóa học 9
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Copyright © 2021 HOCTAP247