Hoá học 9 Bài 52: Tinh bột và xenlulozơ
Tóm tắt bài
1.1. Trạng thái tự nhiên và tính chất vật lí
Hình 1: Một số hình ảnh về Tinh bột và Xenlulozơ
- Tinh bột:
- Có nhiều ở các loại hạt, củ, quả thuộc cây lương thực như ngô, khoai, sắn, lúa,...
-
Chất rắn, màu trắng, chỉ tan trong nước nóng tạo dung dịch hồ tinh bột
- Xenlulozơ:
-
Có nhiều ở các loại rau, thân cây, quả bông (chất xơ) như tre, nứa, ...
-
Chất rắn, màu trắng, không tan trong nước
-
1.2. Đặc điểm công thức phân tử
a)Tinh bột
Hình 2: Cấu trúc phân tử tinh bột
- Mạch nhánh
- Số mắt xích trong phân tử tinh bột là n \(\approx\) 1200 - 6000
b) Xenlulozơ
Hình 3: Cấu trúc phân tử Xenlulozơ
- Mạch không phân nhánh
- Số mắt xích trong phân tử Xenlulozơ là n \(\approx\) 10 000 - 14 000
1.3. Tính chất hóa học
a) Phản ứng thủy phân
- Khi đun nóng trong dung dịch axit loãng tinh bột và xenlulozơ bị thủy phân thành glucozơ
(–C6H10O5 –)n + nH2O \(\xrightarrow[t^{0}]{Axit}\) nC6H12O6
- Ở nhiệt độ thường tinh bột và xenlulozơ bị thủy phân thành glucozơ nhờ xúc tác của các enzym
b) Tác dụng của tinh bột với Iod
- Cách em quan sát thí nghiệm sau:
Video 1: Phản ứng của hồ tinh bột với Iod
- Hiện tượng: Khi cho vài giọt dung dịch Iod vào ống nghiệm có chứa tinh bột, dung dịch có màu xanh đen. Khi đun nóng hỗn hợp, dung dịch trong ống nghiệm bị mất màu. Làm lạnh hỗn hợp, màu xanh đen lại xuất hiện.
- Giải thích: Do sự hấp phụ Iod vào các khe trống trong tinh bột tạo màu xanh đen. Khi đun nóng, các phân tử Iod được giải phóng làm mất màu xanh đen; Khi làm lạnh, Iod bị hấp phụ trở lại tạo màu xanh đen.
⇒ Phương pháp dùng để nhận biết Hồ tinh bột và ngược lại (dùng để nhận biết Iod)
1.4. Ứng dụng của Tinh bột và Xenlulozơ
- Quá trình quang hợp của cây: 6nCO2 + 5nH2O \(\xrightarrow[anh\,\,sang]{clorofin}\)(-C6H10O5 - )n + 6nO2
- Tinh bột là lương thực quan trọng của con người, ngoài ra còn là nguyên liệu quan trọng để sản xuất Glucozơ và rượu etylic

Hình 4: Một số thực phẩm chứa nhiều tinh bột
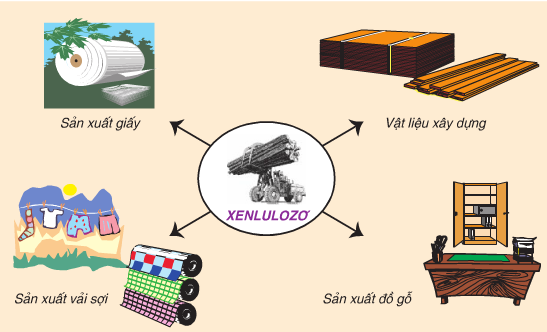
- Xenlulozơ có những ứng dụng chủ yếu sau:
Hình 5: Ứng dụng của Xenlulozơ
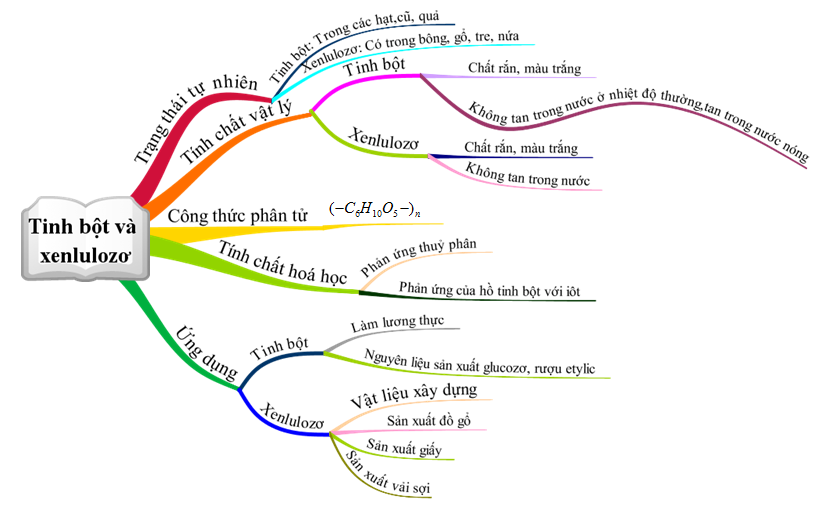
1.5. Tổng kết
Hình 6: Sơ đồ tư duy bài Tinh bột và Xenlulozơ
Bài 1:
Khi thuỷ phân 1 kg bột gạo có chứa 80% tinh bột, thì khối lượng glucozơ thu được là bao nhiêu? Giả thiết rằng phản ứng xảy ra hoàn toàn.
Hướng dẫn:
Khối lượng tinh bột có chứa trong 1 kg bột gạo là:
\({m_{tinh\,\,bot}} = 1.\frac{{80}}{{100}} = 0,8(kg)\)
Phương trình hóa học:
(–C6H10O5 –)n + nH2O \(\xrightarrow[t^{0}]{Axit}\) nC6H12O6
M: 162.n 180.n
m: 0,8 (kg) → \(\frac{{0,8.180n}}{{162n}} = \frac{8}{9} \approx 0,89(kg)\)
Vậy khối lượng Glucozơ thu được là 0,89 kg
Bài 2:
Để sản xuất ancol etylic, người ta dùng nguyên liệu là mùn cưa và vỏ bào từ gỗ chứa 50% xenlulozơ. Nếu muốn điều chế 1 tấn ancol etylic, hiệu suất quá trình là 70% thì khối lượng nguyên liệu cần dùng là bao nhiêu?
Hướng dẫn:
Nhận xét: Đề bài có 2 phương trình tinh bột tạo glucozơ và phản ứng lên men glucozơ tạo rượu etylic. Tuy nhiên, để ý một chút ta nhận thấy từ tinh bột tạo Glucozơ là 6C tạ 6C nên hệ số là 1 : 1. Khi chuyển sang phản ứng từ Glucozơ cũng 6C nhưng lại tạo 2C2H5OH + 2CO2 nữa mới đủ 6C.
Cụ thể sơ đồ phản ứng như sau:
(–C6H10O5 –)n → nC6H12O6 → 2nC2H5OH
M: 162.n 2.n.46
m: \(\frac{{1.162.n}}{{2.n.46}} = \frac{{81}}{{46}}\)(tấn) \(\leftarrow\) 1 tấn
Vì nguyên liệu chỉ chứa 50% là Xenlulozơ và hiệu suất phản ứng chỉ đạt 70% nên cần dùng lượng nguyên liệu là:
mnguyên liệu = \(\frac{{81}}{{46}}.\frac{{100}}{{70}}.\frac{{100}}{{50}} = 5,03\) (tấn)
3. Luyện tập Bài 52 Hóa học 9
Sau bài học cần nắm:
- Công thức của tinh bột và xenlulozơ là gì?
- Nó có những tính chất và ứng dụng như thế nào?
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 9 Bài 52 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
Câu 1:
Chọn câu đúng nhất.
- A. Tinh bột và xenlulozơ dễ tan trong nước.
- B. Tinh bột dễ tan trong nước còn xenlulozơ không tan trong nước.
- C. Tinh bột và xenlulozơ không tan trong nước lạnh nhưng tan trong nước nóng
- D. Tinh bột không tan trong nước lạnh nhưng tan một phần trong nước nóng. Còn xenlulozơ không tan cả trong nước lạnh và nước nóng.
-
- A. 1200 – 6000.
- B. 6000 – 10000.
- C. 10000 -14000.
- D. 12000- 14000.
-
- A. quỳ tím.
- B. iot.
- C. NaCl.
- D. glucozơ.
Câu 3- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 9 Bài 52.
Bài tập 1 trang 158 SGK Hóa học 9
Bài tập 2 trang 158 SGK Hóa học 9
Bài tập 3 trang 158 SGK Hóa học 9
Bài tập 4 trang 158 SGK Hóa học 9
Bài tập 52.1 trang 60 SBT Hóa học 9
Bài tập 52.2 trang 60 SBT Hóa học 9
Bài tập 52.3 trang 60 SBT Hóa học 9
Bài tập 52.4 trang 60 SBT Hóa học 9
4. Hỏi đáp về Bài 52 chương 5 Hóa học 9
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Copyright © 2021 HOCTAP247