Dưới đây là đồ thị biểu diễn mối quan hệ giữa thời gian điện phân và pH của dung dịch khi điện phân 400ml (xem thể tích không đổi) dung dịch gồm KCl, HCl và CuCl2 0,02M (điện cực t...
Câu hỏi :
Dưới đây là đồ thị biểu diễn mối quan hệ giữa thời gian điện phân và pH của dung dịch khi điện phân 400ml (xem thể tích không đổi) dung dịch gồm KCl, HCl và CuCl2 0,02M (điện cực trơ, màng ngăn xốp) với cường độ dòng điện bằng I = 1,93A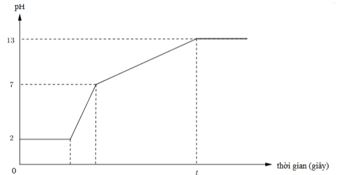
A. 3000.
B. 1200
C. 1800.
D. 3600.
* Đáp án
A
* Hướng dẫn giải
Đáp án A
đọc đồ thị:
• đoạn thằng y = 2 ứng với quá trình điện phân CuCl2 → Cu + Cl2, pH của dung dịch không đổi.
và từ pH = 2 → CM (HCl) = 0,01 mol → có 0,004 mol HCl trong dung dịch ban đầu.
• đoạn thằng tiếp theo (2 → 7) là quá trình điện phân HCl → H2 + Cl2, nồng độ H+ giảm dần nên pH từ 2 → 7.
tại pH = 7 là ứng với thời điểm mà HCl điện phân hết, bắt đầu quá trình tiếp theo, dung dịch lúc này chỉ còn KCl.
• tiếp đó là quá quá trình: KCl + H2O → KOH + H2 + Cl2; pH = 13 → CM (KOH) = 0,1 M
||→ có 0,04 mol KOH → ứng với 0,04 mol KCl. sau quá trình này, chỉ có H2O bị điện phân,
pH ổn đinh = 13 và không đổi (trừ khi nước bị điện phân nhiều và tính sự thay đổi của H2O).
Tóm lại, ứng tại thời điểm t, ∑nCl2 ra bên anot = 0,008 + 0,004 ÷ 2 + 0,04 ÷ 2 = 0,03 mol.
||→ ne trao đổi = 0,06 mol ||→ t = Ans × 96500 ÷ 1,93 = 3000 giây.
Câu hỏi trên thuộc đề trắc nghiệm dưới đây !
Đề thi thử THPT QG năm 2021 môn Hóa học Trường THPT Lê Hồng Phong
Copyright © 2021 HOCTAP247
