Ôn tập Hóa Học 10 cực hay có lời giải !!
Câu 1 : Đồng có 2 đồng vị là và . Khối lượng nguyên tử trung bình của đồng là 63,54. Thành phần phần trăm số nguyên tử của đồng vị
A. 20%.
B. 70%.
C. 73%.
D. 27%
Câu 2 : Nguyên tử P (Z = 15) có số electron ở lớp ngoài cùng là
A. 7.
B. 4.
C. 8.
D. 5.
Câu 3 : Số electron tối đa chứa trong các phân lớp s, p, d, f lần lượt là
A. 2, 8, 18, 32.
B. 2, 6, 10, 14.
C. 2, 6, 8, 18.
D. 2, 4, 6, 8.
Câu 4 : Có các đồng vị sau . Có thể tạo ra số phân tử hidro clorua (HCl) là
A. 2.
B. 5.
C. 3.
D. 4.
Câu 5 : Hầu hết các nguyên tử được cấu tạo bởi số loại hạt cơ bản là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 6 : Trong nguyên tử, loại hạt có khối lượng không đáng kể so với các hạt còn lại là
A. proton
B. nơtron.
C. electron.
D. nơtron và electron
Câu 7 : Số electron tối đa trong lớp thứ 3 là
A. 18e.
B. 9e.
C. 32e.
D. 8e.
Câu 8 : Trong nguyên tử, hạt mang điện là
A. electron.
B. proton, electron.
C. proton, nơtron.
D. electron, nơtron.
Câu 9 : Dựa vào thứ tự mức năng lượng, xét xem sự sắp xếp các phân lớp nào sau đây sai?
A. 1s < 2s
B. 4s > 3s.
C. 3d < 4s.
D. 3p < 3d.
Câu 10 : Phát biểu nào sau đây không đúng?
A. Nguyên tử của hầu hết các nguyên tố được cấu tạo bởi 2 loại hạt là proton và nơtron.
B. Trong nguyên tử, số proton và số electron bằng nhau.
C. Đồng vị là tập hợp các nguyên tố có cùng số proton nhưng khác nhau số nơtron.
D. Trong nguyên tử, số proton luôn bằng số hiệu nguyên tử Z.
Câu 11 : Nguyên tử của nguyên tố X có tổng số hạt cơ bản là 49, trong đó số hạt không mang điện bằng 53,125% số hạt mang điện. Số đơn vị điện tích hạt nhân của X là
A. 18.
B. 17.
C. 15.
D. 16.
Câu 12 : Số khối của nguyên tử bằng tổng
A. số n và e.
B. số p và e.
C. sổng số n, e, p.
D. số p và n.
Câu 13 : Số nơtron trong nguyên tử là
A. 20.
B. 39.
C. 19.
D. 58.
Câu 14 : Cấu hình electron của nguyên tố S (Z = 16) là
A.
B.
C.
D.
Câu 15 : Đồng vị là những nguyên tử có cùng
A. số electron nhưng khác nhau số điện tích hạt nhân.
B. số proton nhưng khác nhau số nơtron.
C. số khối nhưng khác nhau số proton.
D. cùng điện tích hạt nhân và số khối.
Câu 16 : Cấu hình electron không đúng là
A. (Z=11) :
B. Na (Z=11) :
C. F (Z=9) :
D. (Z=9) :
Câu 17 : Số phân lớp electron của lớp M (n = 3) là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 18 : Cho những nguyên tử của các nguyên tố sau:
A. 1 và 2
B. 2 và 3
C. 1, 2 và 3
D. Cả 1, 2, 3, 4
Câu 19 : Nguyên tử nguyên tố A có phân lớp ngoài cùng là 3p. Tổng electron ở các phân lớp p là 9. Nguyên tố A là
A. S (Z = 16).
B. Si (Z = 12).
C. P (Z = 15).
D. Cl (Z = 17).
Câu 20 : Cấu hình electron nào sau đây là của kim loại?
A.
B.
C.
D.
Câu 21 : Nguyên tử của nguyên tố X có cấu hình electron phân lớp sát ngoài cùng và phân lớp ngoài cùng là . Tổng số electron trong 1 nguyên tử của X là
A. 24.
B. 22.
C. 20.
D. 18.
Câu 22 : Nguyên tử nào trong hình vẽ dưới đây có số e lớp ngoài cùng là 5?
A. 1 và 2
B. 1 và 3
C. 3 và 4
D. 1 và 4
Câu 23 : Cho 2 nguyên tố M và N có số hiệu nguyên tử lần lượt là 11 và 13. Cấu hình của M và N là:
A. và
B. và
C. và
D. và
Câu 24 : Trong tự nhiên, đồng có 2 đồng vị và . Biết chiếm 73% số nguyên tử. Nguyên tử khối trung bình của đồng là
A. 64.
B. 63.
C. 65.
D. 63,54
Câu 25 : Nguyên tố R có công thức oxit cao nhất là . Hợp chất với hidro của R chứa 75% khối lượng R. R là
A. C.
B. S.
C. Cl.
D. Si
Câu 26 : Số nguyên tố trong chu kì 3 và 5 là
A. 8 và 18.
B. 8 và 8.
C. 18 và 8.
D. 18 và 18.
Câu 27 : Tổng số hạt cơ bản của nguyên tử một nguyên tố X là 13, hóa trị cao nhất của nguyên tố X với oxi là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 28 : Cho 4,6 gam một kim loại kiềm R tác dụng hoàn toàn với nước thu được 2,24 lít khí H2 (đktc). R là
A. Li.
B. Na
C. K
D. Rb.
Câu 29 : Các nguyên tố nhóm B trong bảng tuần hoàn là
A. các nguyên tố d và f.
B. các nguyên tố s.
C. các nguyên tố s và p.
D. các nguyên tố p.
Câu 30 : Nguyên tố M thuộc nhóm VIA. Trong oxit cao nhất M chiếm 40% khối lượng. Công thức oxit đó là
A. .
B. CO.
C. .
D. .
Câu 31 : Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân
A. tính kim loại và tính phi kim đều tăng dần.
B. tính kim loại giảm dần, tính phi kim tăng dần.
C. tính kim loại tăng dần, tính phi kim giảm dần.
D. tính phi kim và tính kim loại đều giảm dần.
Câu 32 : Sắp xếp các bazơ: , , theo độ mạnh tăng dần
A. NaOH < < .
B. < NaOH < .
C. < < NaOH.
D. < NaOH < .
Câu 33 : Cho: . Thứ tự tính kim loại tăng dần là:
A. P, Al, Mg, Si, Ca.
B. P, Si, Al, Ca, Mg.
C. P, Si, Mg, Al, Ca.
D. P, Si, Al, Mg, Ca.
Câu 34 : Cấu hình electron của X thuộc nhóm A, chu kỳ 4, có 2 electron lớp ngoài cùng là
A.
B.
C.
D.
Câu 35 : Cho dãy nguyên tố nhóm VA: N – P – As – Sb – Bi. Nguyên tử của nguyên tố có bán kính nhỏ nhất là
A. Nitơ.
B. Asen.
C. Bitmut.
D. Photpho.
Câu 36 : Trong bảng tuần hoàn các nguyên tố hóa học có số chu kì nhỏ là
A. 2.
B. 1.
C. 3.
D. 4.
Câu 37 : Mệnh đề nào sau đây sai?
A. Trong 1 chu kỳ theo chiều tăng dần của điện tích hạt nhân hóa trị cao nhất của các nguyên tố trong hợp chất với oxi tăng từ 1 đến 7.
B. Trong 1 chu kỳ theo chiều tăng dần của điện tích hạt nhân bán kính nguyên tử và tính kim loại giảm dần.
C. Trong 1 chu kỳ theo chiều tăng dần của điện tích hạt nhân giá trị độ âm điện và tính phi kim tăng dần.
D. Trong 1 chu kỳ theo chiều tăng dần của điện tích hạt nhân hóa trị cao của các phi kim trong hợp chất với H tăng từ 1 đến 4.
Câu 38 : X và Y là hai nguyên tố liên tiếp nhau trong một chu kì (ZX < ZY). Biết tổng số proton của X và Y là 31. Cấu hình electron của Y là
A.
B.
C.
D.
Câu 39 : Độ âm điện của dãy nguyên tố trong chu kì 3: biến đổi như thế nào?
A. Tăng dần.
B. Vừa giảm vừa tăng.
C. Không thay đổi.
D. Giảm dần.
Câu 40 : Kết luận nào sau đây không đúng khi nói về ?
A. Có 20 nơtron trong hạt nhân.
B. Là nguyên tố mở đầu chu kỳ 4.
C. Nguyên tử có 7 electron ở lớp ngoài cùng.
D. Thuộc chu kỳ 4, nhóm IA.
Câu 41 : Cho dãy nguyên tố nhóm IA: Li – Na – K – Rb – Cs. Theo chiều điện tích hạt nhân tăng, tính kim loại
A. Giảm rồi tăng.
B. Tăng dần.
C. Giảm dần.
D. Tăng rồi giảm.
Câu 42 : Nguyên tố R có công thức oxit cao nhất là . Công thức hợp chất khí với hidro của R là
A. .
B. .
C. .
D. .
Câu 43 : X, Y là hai nguyên tố liên tiếp nhau trong 1 nhóm và có tổng số hiệu nguyên tử là 32 (). Số hiệu nguyên tử của X, Y lần lượt là
A. 14, 18.
B. 7, 15.
C. 12, 20.
D. 15, 17.
Câu 44 : Cho 10 gam hỗn hợp hai kim loại kiềm tan hoàn toàn vào 100ml () thu được dung dịch A và 2,24 lít khí (đktc). Khối lượng dung dịch A là
A. 11,7 gam.
B. 109,8 gam.
C. 9,8 gam.
D. 110 gam.
Câu 45 : Oxit cao nhất của một nguyên tố R thuộc nhóm A là . Nguyên tố R có thể là
A. N (Z = 7).
B. F (Z = 9).
C. Cl (Z = 17).
D. S (Z = 16).
Câu 46 : Những tính chất nào sau đây không biến đổi tuần hoàn?
A. Số electron lớp ngoài cùng.
B. Tính kim loại, tính phi kim.
C. Số lớp electron.
D. Hóa trị cao nhất với oxi.
Câu 47 : Nguyên tử của nguyên tố Y có cấu hình electron lớp ngoài cùng là . Vị trí của Y trong bảng tuần hoàn là
A. Ô 16, chu kỳ 3, nhóm VIA.
B. Ô 16, chu kỳ 3, nhóm VIB.
C. Ô 17, chu kỳ 4, nhóm IIIA.
D. Ô 17, chu kỳ 3, nhóm IVA.
Câu 48 : Nguyên tử của nguyên tố X có tổng số hạt mang điện trong hạt nhân là 13. Vị trí của X trong bảng tuần hoàn là
A. Chu kỳ 3, nhóm IIIA.
B. Chu kỳ 2, nhóm IIIA.
C. Chu kỳ 3, nhóm IIA.
D. Chu kỳ 3, nhóm VIIA.
Câu 49 : Hợp chất với hidro của nguyên tố X có công thức . Biết phần trăm về khối lượng của oxi trong oxit cao nhất của X là 74,07%. Nguyên tử khối của X là
A. 32.
B. 52.
C. 14.
D. 31.
Câu 50 : Nguyên tử của nguyên tố có khuynh hướng nhận thêm 2 electron trong các phản ứng hóa học là
A. Na (Z = 11).
B. O (Z = 8).
C. N (Z = 7).
D. Cl (Z = 17).
Câu 51 : Một nguyên tố R có cấu hình electron . Công thức oxit cao nhất và công thức hợp chất với hidro của R là
A. và .
B. và .
C. và .
D. và .
Câu 52 : Cho các nguyên tố Chiều giảm dần tính phi kim của chúng là
A. F > Cl > S > Si.
B. F > Cl > Si > S.
C. Si > S > F > Cl.
D. Si > S > Cl > F.
Câu 53 : Theo chiều tăng dần của điện tích hạt nhân, tính bazơ của oxit, hidroxit ứng với các nguyên tố trong nhóm IIA là
A. Giảm dần.
B. Giảm rồi tăng.
C. Không đổi.
D. Tăng dần.
Câu 54 : Cho các hình vẽ sau là 1 trong các nguyên tử Na (Z = 11), Mg (Z = 12), Al (Z = 13), K (Z = 19).
A. Na, Mg, Al, K.
B. K, Na, Mg, Al.
C. Al, Mg, Na, K.
D. K, Al, Mg, Na.
Câu 55 : Ion có cấu hình electron phân lớp ngoài cùng là . R thuộc chu kì, nhóm nào sau đây?
A. Chu kì 4, nhóm IIA.
B. Chu kì 4, nhóm IA.
C. Chu kì 3, nhóm VIA.
D. Chu kì 3, nhóm VIIIA.
Câu 56 : Các nguyên tố xếp ở chu kì 5 có số lớp electron trong nguyên tử là
A. 5.
B. 4.
C. 3.
D. 6.
Câu 57 : Trong bảng tuần hoàn các nguyên tố, số chu kì nhỏ và chu kì lớn là
A. 3 và 3.
B. 4 và 3.
C. 3 và 4.
D. 4 và 4.
Câu 58 : Nhóm A bao gồm các nguyên tố
A. Nguyên tố s.
B. nguyên tố p.
C. nguyên tố d và nguyên tố f.
D. nguyên tố s và nguyên tố p.
Câu 59 : Nguyên tố nào sau đây có độ âm điện lớn nhất?
A. F.
B. O.
C. Na.
D. S.
Câu 60 : Nhóm IA trong bảng tuần hoàn có tên gọi
A. Nhóm kim loại kiềm.
B. Nhóm kim loại kiềm thổ.
C. Nhóm halogen.
D. Nhóm khí hiếm.
Câu 61 : Chu kì là tập hợp các nguyên tố mà nguyên tử của chúng có cùng
A. Số lớp electron.
B. Số electron hóa trị.
C. Số hiệu nguyên tử.
D. Số electron lớp ngoài cùng
Câu 62 : Nguyên tố R ó công thức cao nhất trong hợp chất với oxi là . Công thức hợp chất khí với hidro là
A. HR.
B. .
C. .
D. .
Câu 63 : Anion có cấu hình electron là . Vị trí của X trong bảng tuần hoàn là
A. chu kì 2, nhóm VIIA.
B. chu kì 2, nhóm VIA.
C. chu kì 6, nhóm IIA.
D. chu kì 2, nhóm VIIIA.
Câu 64 : Hòa tan 0,3 gam hỗn hợp 2 kim loại X và Y thuộc 2 chu kì liên tiếp của nhóm IA () vào thì thu được 0,224 lít khí ở điều kiện tiêu chuẩn. X và Y là
A. Li và Na.
B. K và Rb.
C. Na và K.
D. Rb và Cs.
Câu 65 : Trong cùng một nhóm A, theo chiều tăng dần của điện tích hạt nhân thì
A. tính kim loại giảm, tính phi kim tăng.
B. tính kim loại tăng, tính phi kim tăng.
C. tính kim loại giảm, tính phi kim giảm.
D. tính kim loại tăng, tính phi kim giảm.
Câu 66 : Oxit cao nhất của một nguyên tố là . Trong hợp chất của nó với hidro có 5,88% H về khối lượng. Nguyên tử khối của nguyên tố R là
A. 27.
B. 32.
C. 16.
D. 31.
Câu 67 : Đại lượng không biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử là
A. Bán kính nguyên tử.
B. Hóa trị cao nhất với oxi.
C. Tính kim loại, tính phi kim.
D. Nguyên tử khối.
Câu 68 : Nguyên tố X thuộc chu kì 3, nhóm VA trong bảng tuần hoàn. Cấu hình electron trong gnuyeen tử X là
A.
B.
C.
D.
Câu 69 : Dãy các nguyên tố nhóm IIA gồm: Mg (Z = 12), Ca (Z = 20), Sr (Z = 38), Ba (Z = 56). Từ Mg đến Ba, theo chiều tăng của điện tích hạt nhân, tính kim loại thay đổi theo chiều
A. Giảm dần.
B. Tăng dần.
C. Giảm rồi tăng.
D. Tăng rồi giảm.
Câu 70 : Các phát biểu về các nguyên tố nhóm VIIA như sau:
A. 1 và 2.
B. 1 và 3.
C. 1, 2 và 3.
D. 2 và 3.
Câu 71 : Trong bảng tuần hoàn nguyên tố X có số thứ tự 11. X thuộc
A. chu kì 3, nhóm IIA.
B. chu kì 2, nhóm IVA.
C. chu kì 2, nhóm IIIA.
D. chu kì 3, nhóm IA.
Câu 72 : Theo định luật tuần hoàn, tính chất hóa học của các nguyên tố biến đổi tuần hoàn theo chiều tăng của
A. Nguyên tử khối.
B. điện tích ion.
C. số oxi hóa.
D. điện tích hạt nhân nguyên tử.
Câu 73 : Các nguyên tố thuộc cùng một nhóm A có tính chất hóa học tương tự nhau, vì vỏ nguyên tử của các nguyên tố nhóm A có
A. số electron như nhau.
B. số lớp electron như nhau.
C. cùng số electron s hay p.
D. số electron thuộc lớp ngoài cùng như nhau.
Câu 74 : Nguyên tố X thuộc nhóm VA trong bảng tuần hoàn. Công thức oxit cao nhất của X là
A..
B..
C..
D.
Câu 75 : Các nguyên tố Li (Z = 3), Na (Z = 11), K (Z = 19), Be (Z = 4) được sắp xếp theo chiều tính kim loại yếu dần theo dãy nào trong các dãy sau đây?
A. Li > Be > Na > K.
B. K > Na > Li > Be.
C. Be > K > Na > Li.
D. Be > Na > Li > K.
Câu 76 : và đều có cấu hình electron là: . Vậy R, X là:
A. Ar, K.
B. K, Cl.
C. P, K.
D. Na, F.
Câu 77 : Nguyên tố X thuộc chu kì 4, nhóm VIIB. Cấu hình electron nguyên tử của nguyên tố X là
A.
B.
C.
D.
Câu 78 : Nguyên tử của nguyên tố X thuộc chu kì 3, nhóm IVA có số hiệu nguyên tử là
A. 14.
B. 22.
C. 21.
D. 13.
Câu 79 : Cho nguyên tử lưu huỳnh ở ô thứ 16. Cấu hình electron của là
A. .
B. .
C. .
D. .
Câu 80 : Phát biểu nào sau đây không đúng?
A. Nguyên tử của các nguyên tố cùng chu kì có số lớp electron bằng nhau.
B. Trong chu kì, các nguyên tố được xếp theo chiều khối lượng nguyên tử tăng dần.
C. Trong chu kì, các nguyên tố được xếp theo chiều điện tích hạt nhân tăng dần.
D. Chu kì 1 có 2 nguyên tố.
Câu 81 : Hòa tan hết 12.34 gam hỗn hợp kim loại X gồm 3 kim loại thuộc nhóm IA và IIA tác dụng với lượng dư dung dịch loãng thu được 4,48 lít khí (đktc) và m gam hỗn hợp muối. Giá trị của m là
A. 31,54.
B. 30,50.
C. 28,14.
D. 45,00.
Câu 82 : Cho các nguyên tố B (Z = 5), Al (Z = 13), C (Z = 6), N (Z = 7) được sắp xếp theo thứ tự giảm dần bán kính nguyên tử theo dãy nào trong các dãy sau?
A. B > C > N > Al.
B. N > C > B > Al.
C. C > B > Al > N.
D. Al > B > C > N.
Câu 83 : Sắp xếp các ion sau theo chiều tăng dần bán kính:
A. , , , .
B. , , , .
C. , , ,.
D. , , , .
Câu 84 :
Cho các nguyên tử sau cùng chu kì và thuộc nhóm A: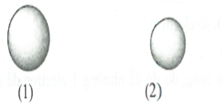

A. (1) > (2) > (3) > (4).
B. (4) > (3) > (2) > (1).
C. (1) > (3) > (2) > (4).
D. (4) > (2) > (1) > (3).
Câu 85 : Các nguyên tố xếp ở chu kì 6 có số lớp electrong trong nguyên tử là
A. 6.
B. 3.
C. 7.
D. 5.
Câu 86 : Nguyên tố X thuộc chu kì 3, nhóm IIA. Nguyên tử của nguyên tố X có cấu hình electron là
A.
B.
C.
D.
Câu 87 : Số nguyên tố trong chu kì 3 và 4 là
A. 8, 16.
B. 8, 32.
C. 8, 18.
D. 2, 8.
Câu 88 : Sắp xếp các bazơ: , , theo độ mạnh tăng dần
A. < < .
B. < < .
C. < < .
D. < < .
Câu 89 : Các nguyên tố nhóm IA có điểm chung là
A. số proton.
B. số nơtron.
C. dễ dàng nhường 1 electron.
D. số electron.
Câu 90 : Nguyên tố X ở chu kì 3, nhóm VIA trong bảng tuần hoàn. Nhận xét sai là
A. X có 6 electron lớp ngoài cùng.
B. X có 4 electron p ở lớp ngoài cùng.
C. X có ba lớp electron.
D. X là nguyên tố khí hiếm.
Câu 91 : Ion có cấu hình electron là: . Vị trí của Y trong bảng tuần hoàn là
A. Chu kì 3, nhóm VIIA.
B. Chu kì 3, nhóm VIIIA
C. Chu kì 4, nhóm IA.
D. Chu kì 4, nhóm IIA.
Câu 92 : Trong 1 chu kì, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử
A. tăng dần.
B. giảm dần.
C. không tăng, không giảm.
D. vừa tăng, vừa giảm.
Câu 93 : Nguyên tố thuộc nhóm VA có hóa trị cao nhất với oxi và hóa trị trong hợp chất với hidro lần lượt là
A. III và III.
B. III và V.
C. V và V.
D. V và III.
Câu 94 : Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân
A. tính kim loại giảm dần, tính phi kim tăng dần.
B. tính kim loại và tính phi kim đều tăng dần.
C. tính kim loại tăng dần, tính phi kim giảm dần.
D. tính phi kim và tính kim loại đều giảm dần.
Câu 95 : Cho:. Thứ tự tính kim loại tăng dần là
A. P, Al, Mg, Si, Ca.
B. P, Si, Al, Ca, Mg.
C. P, Si, Mg, Al, Ca.
D. P, Si, Al, Mg, Ca.
Câu 96 : Nguyên tử của nguyên tố nào sau đây luôn nhường 2 electron trong các phản ứng hóa học
A. Na (Z = 11).
B. Mg (Z = 12).
C. Al (Z = 13).
D. F (Z = 9).
Câu 97 : Số thứ tự ô nguyên tố không cho biết
A. số electron ở lớp vỏ.
B. số proton trong hạt nhân.
C. số nơtron trong hạt nhân.
D. số hiệu nguyên tử.
Câu 98 : Số thứ tự của nhóm A được xác định bằng
A. số electron độc thân.
B. số electron của 2 phân lớp (n – 1)dns
C. số electron thuộc lớp ngoài cùng.
D. số electron ghép đôi.
Câu 99 : Cặp nguyên tố nào sau đây có tính chất hóa học tương tự nhau?
A. Na và K.
B. K và Ca.
C. Na và Mg.
D. Mg và Al.
Câu 100 : Nguyên tố ở chu kì 4, nhóm VIB có cấu hình electron hóa trị là
A. .
B.
C.
D.
Câu 101 : Cho các nguyên tử Na (Z = 11), K (Z = 19), Mg (Z = 12). Thứ tự tăng dần bán kính của các nguyên tử trên là
A. Na < Mg < K.
B. K < Mg < Na.
C. Mg < Na < K.
D. K < Na < Mg.
Câu 102 : Nguyên tử của nguyên tố X có tổng số electron ở phân lớp p bằng 7. Vị trí của X trong bảng hệ thống tuần hoàn là
A. Ô 13, chu kì 3, nhóm IIIA.
B. Ô 12, chu kì 3, nhóm IIA.
C. Ô 20, chu kì 4, nhóm IIA.
D. Ô 19, chu kì 4, nhóm IA.
Câu 103 : M có cấu hình electron là . Vị trí của M trong bảng tuần hoàn là
A. Ô 23, chu kì 4, nhóm IIA.
B. Ô 23, chu kì 4, nhóm IIIB.
C. Ô 23, chu kì 4, nhóm VB.
D. Ô 23, chu kì 4, nhóm VA.
Câu 104 : Cation và anion đều có cấu hình electron ở phân lớp ngoài cùng là . Vị trí của X và Y trong bảng tuần hoàn là
A. X ở ô 11, chu kì 3, nhóm IA và Y ở ô 8, chu kì 2, nhóm VIA.
B. X ở ô 12, chu kì 3, nhóm IIA và Y ở ô 8, chu kì 2, nhóm VIA.
C. X ở ô 13, chu kì 3, nhóm IIIA và Y ở ô 9, chu kì 2, nhóm VIIA.
D. X ở ô 12, chu kì 3, nhóm IIA và Y ở ô 9, chu kì 2, nhóm VIIA.
Câu 105 : Cation có cấu hình electron ở lớp ngoài cùng là . Vị trí nguyên tố X trong bảng tuần hoàn là
A. Chu kì 3, nhóm IIIA, là nguyên tố kim loại.
B. Chu kì 4, nhóm IIIB, là nguyên tố kim loại.
C. Chu kì 3, nhóm VIA, là nguyên tố phi kim.
D. Chu kì 4, nhóm IVB, là nguyên tố kim loại.
Câu 106 : Nguyên tố R ở nhóm IIA trong bảng tuần hoàn, trong hợp chất hidroxit % khối lượng của oxi chiếm 43,24%. Nguyên tố R là
A. Mg.
B. Ca.
C. Sr.
D. Ba.
Câu 107 : Nguyên tử R có cấu hình electron lớp ngoài cùng là . Trong công thức hợp chất với H của nó có chứa 5,88% H về khối lượng. Nguyên tố R là
A. O.
B. Se.
C. Te.
D. S.
Câu 108 : Nguyên tố X tạo hợp chất oxit cao nhất ứng với công thức . Trong hợp chất khí với hidro, nguyên tố X chiếm 94,12% về khối lượng. Tính phi kim tăng dần là
A. X, P, O.
B. P, X, O.
C. O, X, P.
D. P, O, X.
Câu 109 : Hòa tan hết 0,8 gam một kim loại X thuộc nhóm IIA vào dung dịch HCl dư thì thu được dung dịch Y và 0,448 lít khí hidro ở điều kiện chuẩn. Kim loại X là
A. Be.
B. Mg.
C. Ca.
D. Ba.
Câu 110 : Hòa tan hết 6,9 gam một kim loại M vào 93,4 gam nước. Sau phản ứng thu được 100 gam dung dịch D. Kim loại M là
A. Na.
B. K.
C. Ca.
D. Ba.
Câu 111 : Hòa tan hoàn toàn 20 gam hỗn hợp X gồm 2 kim loại kiềm thổ A, B thuộc 2 chu kì liên tiếp () vào dung dịch HCl dư thu được 15,68 lít khí (đktc). Phần trăm khối lượng của A trong X là
A. 40,00%.
B. 71,43%.
C. 60,00%.
D. 28,57%.
Câu 112 : Một nguyên tố R có tổng số hạt mang điện và không mang điện là 34, trong đó số hạt mang điện gấp 11/6 lần số hạt không mang điện. Vị trí của R trong bảng tuần hoàn là
A. chu kì 3, nhóm IA.
B. chu kì 2, nhóm IA.
C.chu kì 3, nhóm IIA.
D. chu kì 2, nhóm IIA.
Câu 113 : A và B là hai nguyên tố liên tiếp nhau trong cùng một chu kì (). Tổng số proton trong hạt nhân hai nguyên tử A và B bằng 49. Vị trí của A trong bảng tuần hoàn là
A. chu kì 4, nhóm IB.
B. chu kì 4, nhóm IIA.
C.chu kì 4, nhóm VIB.
D. chu kì 3, nhóm IIB.
Câu 114 : Cho các nguyên tử sau cùng thuộc một chu kì trong bảng tuần hoàn:
A. a > b > c > d.
B. d > c > b > a.
C. a > c > b > d.
D. d > b > c > a.
Câu 115 : Cho nguyên tố oxi có Z = 8, trong bảng tuần hoàn oxi thuộc nhóm
A. VIIIA.
B. IIA.
C. VIA.
D. IVA.
Câu 116 : Nguyên tố As ở nhóm VA, công thức oxit cao nhất của As là
A. .
B. .
C. .
D. .
Câu 117 : Cho nguyên tố P ở nhóm VA, P là
A. kim loại.
B. phi kim.
C. khí hiếm.
D. á kim.
Câu 118 : Nguyên tố R có công thức oxit cao nhất là , trong bảng tuần hoàn R thuộc nhóm
A. IVA.
B. VA.
C. VIA.
D. VIIA.
Câu 119 : Vị trí của Ca (Z = 20) trong bảng tuần hoàn là
A. chu kì 2, nhóm IVA.
B. chu kì 4, nhóm IIA.
C. chu kì 6, nhóm IIA.
D. chu kì 4, nhóm IVA.
Câu 120 : Cho các nguyên tố sau: Cl (Z = 17); F (Z = 9); Br (Z = 35) và I (Z = 53) đều thuộc nhóm VIIA. Thứ tự các nguyên tố trên sắp xếp theo chiều bán kính nguyên tử tăng dần là
A. I < Cl < F < Br.
B. I < Cl < Br < F.
C. F < Cl < Br < I.
D. Br < F < Cl < I.
Câu 121 : Nguyên tố có tính phi kim mạnh nhất là
A. F.
B. O.
C. S.
D. Cl.
Câu 122 : Phát biểu nào sau đây sai?
A. Các nguyên tố nhóm VIIIA có 8 electron ở lớp ngoài cùng.
B. Các nguyên tố nhóm VIA có 6 electron ở lớp ngoài cùng.
C. Các nguyên tố nhóm IA có 1 electron ở lớp ngoài cùng.
D. Các nguyên tố nhóm IIIA có 3 electron ở lớp ngoài cùng.
Câu 123 : Từ nhóm IV đến VIIA, tổng của hóa trị cao nhất với oxi và hóa trị trong hợp chất khí với hidro của 1 nguyên tố là
A. 4.
B. 7.
C. 3.
D. 8.
Câu 124 : Nguyên tố R có công thức hợp chất khí với hidro là , trong bảng tuần hoàn R thuộc nhóm
A. VA.
B. IVA.
C. VIIA.
D. VIA.
Câu 125 : Cho nguyên tố K ở nhóm IA, K là
A. kim loại.
B. phi kim.
C. khí hiếm.
D. á kim.
Câu 126 : Nguyên tố X có tổng số proton, nơtron, electron là 18, vậy X thuộc
A. chu kì 2, nhóm IVA.
B. chu kì 2, nhóm IIA.
C. chu kì 3, nhóm IVA.
D. chu kì 3, nhóm IIA.
Câu 127 : Nguyên tố Y là phi kim thuộc chu kì 3, có công thức oxit cao nhất là . Y tạo với kim loại M một hợp chất có công thức , trong đó M chiếm 46,67% khối lượng. Nguyên tố M là
A. Cu.
B. Mg.
C. Pb.
D. Fe.
Câu 128 : Hợp chất khí với hidro của nguyên tố R là . Oxit cao nhất của nó chứa 53,33% oxi về khối lượng. Nguyên tố R là
A. C.
B. Si.
C. Pb.
D. S.
Câu 129 : Cho các nguyên tố lần lượt có cấu hình electron như sau:
A. X, Y, H.
B. X, Z, G.
C. X, Z.
D. Z, T.
Câu 130 : Cấu hình electron phân lớp ngoài cùng của 2 nguyên tử A và B lần lượt là và . Biết rằng phân lớp 3s của 2 nguyên tử A và B hơn kém nhau chỉ 1 electron. Hai nguyên tố A, B lần lượt là
A. Na và Cl.
B. Mg và Cl.
C. Na và S.
D. Mg và S.
Câu 131 : Cho B (Z = 5), C (Z = 6), Mg (Z = 12), Al (Z = 13). Dãy các nguyên tố được sắp xếp theo thứ tự độ âm điện tăng dần là
A. Mg, B, Al, C.
B. B, Mg, Al, C.
C. Mg, Al, B, C.
D. Al, B, Mg, C.
Câu 132 : Cho F (Z = 9), S (Z = 16), Cl (Z = 17). Dãy gồm các phi kim được sắp xếp theo thứ tự tính phi kim giảm dần
A. Cl, F, S.
B. F, Cl, S.
C. S, Cl, F.
D. F, S, Cl.
Câu 133 : Dãy các ion có bán kính giảm dần là
A. , , , .
B. , , , .
C. , , , .
D. , , , .
Câu 134 : Electron cuối cùng của nguyên tố M điền vào phân lớp . Vị trí của M trong bảng tuần hoàn là
A. chu kì 3, nhóm IIIB.
B. chu kì 3, nhóm VB.
C. chu kì 4, nhóm IIB.
D. chu kì 4, nhóm VB.
Câu 135 : Cho hay nguyên tố X, Y () đứng kế tiếp nhau trong bảng tuần hoàn và có tổng số đơn vị điện tích hạt nhân là 37. Khẳng định nào sau đây là đúng?
A. X, Y thuộc cùng một chu kì.
B. X là phi kim, Y là kim loại.
C. X có 4 lớp electron.
D. Y thuộc nhóm IA.
Câu 136 : Cho 7,8 gam kim loại X tác dụng hết với nước, thu được 2,24 lít (đktc). Kim loại X là
A. Na.
B. Li.
C. Ca.
D. K.
Câu 137 : Các kim loại X, Y, Z có cấu hình electron nguyên tử lần lượt là: ; ; . Dãy gồm các kim loại xếp theo chiều tang dần tính kim loại từ trái sang phải là
A. X, Y, Z.
B. Z, X, Y.
C. Z, Y, X.
D. Y, Z, X.
Câu 138 : Phát biểu nào sau đây là sai?
A. Nguyên tử kim loại thường có 1, 2 hoặc 3 electron ở lớp ngoài cùng.
B. Các nhóm A bao gồm các nguyên tố s và nguyên tố p.
C. Trong một chu kì, bán kính nguyên tử kim loại nhỏ hơn bán kính nguyên tử phi kim.
D. Nguyên tử phi kim thường có 5, 6 hoặc 7 electron lớp ngoài cùng.
Câu 139 : So với nguyên tử canxi (Z =20), nguyên tử kali (Z = 19) có
A. bán kính lớn hơn và độ âm điện lớn hơn.
B. bán kính lớn hơn và độ âm điện nhỏ hơn.
C. bán kính nhỏ hơn và độ âm điện nhỏ hơn.
D. bán kính nhỏ hơn và độ âm điện lớn hơn.
Câu 140 : X và Y là hai nguyên tố thuộc cùng một chu kỳ, hai nhóm A liên tiếp. Số proton của nguyên tử Y nhiều hơn số proton của nguyên tử X. Tổng số hạt proton trong nguyên tử X và Y là 33. Nhận xét nào sau đây về X, Y là đúng?
A. X thuộc nhóm VA, Y thuộc nhóm VIA.
B. Độ âm điện của X lớn hơn độ âm điện của Y.
C. Lớp ngoài cùng của nguyên tử Y (ở trạng thái cơ bản) có 5 electron.
D. Phân lớp ngoài cùng của nguyên tử X (ở trạng thái cơ bản) có 4 electron.
Câu 141 : Cho các nguyên tử thuộc cùng chu kì sau đây:
A. (1) < (2) < (3) < (4).
B. (4) < (3) < (2) < (1).
C. (4) < (2) < (3) < (1).
D. (1) < (3) < (2) < (4).
Câu 142 : Cho nguyên tử của nguyên tố X có cấu tạo như hình vẽ
A. Ô số 7, chu kì 2, nhóm VIIA.
B. Ô số 7, chu kì 2, nhóm VA.
C. Ô số 5, chu kì 2, nhóm VA.
D. Ô số 5, chu kì 7, nhóm VIIA.
Câu 143 : cho ion đơn nguyên tử X có điện tích 2+ có cấu tạo như hình vẽ
A. Ô số 10, chu kì 2, nhóm VIIIA.
B. Ô số 12, chu kì 3, nhóm VIIIA.
C. Ô số 12, chu kì 3, nhóm IIA.
D. Ô số 10, chu kì 2, nhóm IIA.
Câu 144 : Cho ion đơn nguyên tử X có điện tích 1-, có cấu tạo như hình vẽ
A. Ô số 10, chu kì 2, nhóm VIIIA.
B. Ô số 10, chu kì 2, nhóm VIIA.
C. Ô số 9, chu kì 2, nhóm VIIA.
D. Ô số 9, chu kì 2, nhóm VIIIA.
Câu 145 : Dãy gồm các phân tử có cùng một kiểu liên kết là
A.
B.
C.
D.
Câu 146 : Dãy chất được sắp xếp theo chiều tăng dần sự phân cực liên kết trong phân tử là
A.
B.
C.
D.
Câu 147 : Dãy chất được sắp xếp theo chiều tăng dần sự phân cực liên kết
A. +1
B. 1+
C. 1
D. 1-
Câu 148 : Số oxi hóa của nguyên tử C trong lần lượt là
A.
B.
C.
D.
Câu 149 : Liên kết hoá học trong phân tử HCl là
A. liên kết ion
B. liên kết cộng hoá trị phân cực
C. liên kết cho - nhận
D. liên kết cộng hoá trị không phân cực
Câu 150 :
Công thức electron của 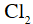 là
là
A.
B.
C.
D.
Câu 151 : Cho biết độ âm điện cứa O là 3,44 và của Si là 1,90. Liên kết trong phân tử là liên kết
A. ion
B. cộng hoá trị phân cực
C. cộng hoá trị không phân cực
D. phối trí
Câu 152 : Số oxi hoá của Mn trong là
A. +7
B. +6
C.
D. +5
Câu 153 : Cộng hoá trị của cacbon và oxi trong phân tử là
A. 4 và 2
B. 4 và
C. +4 và
D. 3 và 2
Câu 154 : Nguyên tố nào dưới đây có độ âm điện lớn nhất trong bảng tuần hoàn?
A. Oxi
B. Clo
C. Brom
D. Flo
Câu 155 : Cặp nguyên tử nào dưới đây tạo hợp chất cộng hoá trị?
A. H và He
B. Na và F
C. H và Cl
D. Li và F
Câu 156 : Cho 2 nguyên tố: X(Z=20), Y(Z=17). Công thức hợp chất tạo thành từ X, Y và liên kết trong phân tư lần lượt là
A. XY: liên kết cộng hoá trị
B. liên kết cộng hoá trị
C. liên kết ion
D. liên kết ion
Câu 157 : Công thức cấu tạo của phân tử HCl là
A.
B.
C.
D.
Câu 158 : Điện hoá trị của các nguyên tố O, S trong các hợp chất với các nguyên tổ kim loại kiềm đều là
A.
B. 2+
C.
D. 6+
Câu 159 : Số oxi hóa của nitơ trong lần lượt là
A.
B.
C.
D.
Câu 160 : Dãy chỉ chứa các hợp chất có liên kết cộng hoá trị là
A.
B.
C.
D.
Câu 161 : Liên kết hoá học trong phân tử là
A. liên kết ion
B. liên kết cộng hoá trị không phân cực
C. liên kết cộng hóa trị phân cực
D. liên kết cho - nhận (phối trí)
Câu 162 : Trong hợp chất ion XY (X là kim loại, Y là phi kim), số electron của cation bằng số electron của anion và tổng số electron trong XY là 20. Biết trong mọi hợp chất, Y chỉ có một mức oxi hóa duy nhất. Công thức XY là
A. LiF
B. NaF
C. AlN
D. MgO
Câu 163 :
Liên kết trong phân tử 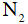 gồm
gồm
A. một liên kết đôi
B. hai liên kết đơn
C. một liên kết ba
D. một liên kết đơn, một liên kết ba
Câu 164 : Nguyên tử nguyên tố X (Z=12) có điện hoá trị trong hợp chất với nguyên tử các nguyên tố nhóm VIIA là
A. 2+
B.
C. 7+
D.
Câu 165 : Phần trăm khối lượng của nguyên tố R trong hợp chất khí với hiđro (R có số oxi hóa thấp nhất) và trong oxit cao nhất tương ứng là a% và b%, với a : b = 11 : 4. Phát biểu nào sau đây là đúng?
A. Phân tử oxit cao nhất của R không có cực
B. Oxit cao nhất của R ở điều kiện thường là chất rắn
C. Trong bảng tuần hoàn các nguyên tố hóa học, R thuộc chu kì 3
D. Nguyên tử R (ở trạng thái cơ bản) có 6 electron s
Câu 166 : Số oxi hóa của lưu huỳnh trong các phân tử lần lượt là
A,
B,
C,
D,
Câu 167 : Cho các phân tử sau: hân tử có liên kết mang nhiều tính chất ion nhất là
A. HCl
B. NaCl
C.
D.
Câu 168 : Số oxi hoá của lưu huỳnh trong ion là
A. +8
B.
C. +6
D. +4
Câu 169 : Chọn sơ đồ nửa phán ứng đúng trong các sơ đồ dưới đây?
A.
B.
C.
D.
Câu 170 : Phân tử nào dưới đây có liên kết cộng hoá trị không phân cực?
A.
B. NaF
C. HF
D.
Câu 171 : Hợp chất nào dưới đây có cả liên kết cộng hoá trị và liên kết ion trong phân tử?
A.
B.
C.
D.
Câu 172 : Công thức electron của HCl là
A.
B.
C.
D.
Câu 173 : Các chất mà phân tử không phân cực là
A. HBr, ,
B. , .
C.
D.
Câu 174 : Ở trạng thái cơ bản:
A. Nguyên tố X và Y thuộc 2 chu kì kế tiếp
B. Số oxi hóa cao nhất của X trong hợp chất là +7
C. Oxit và hiđroxit của Y có tính lưỡng tính
D. Độ âm điện giảm dần theo thứ tự X, Y, Z
Câu 175 : Cho biết cấu hình electron của X và Y lần lượt là: và . Nhận xét nào sau đây đúng?
A. X và Y đều là kim loại.
B. X là phi kim còn Y là kim loại.
C. X và Y đều là các khí hiếm.
D. X và Y đều là các phi kim.
Câu 176 : Cho biết Cu (Z = 29). Cấu hình electron của Cu là
A.
B.
C.
D.
Câu 177 : Nguyên tố X có số hiệu nguyên tử là 14. Phát biểu nào sau đây đúng?
A. X là nguyên tố s.
B. X có 2 electron lớp ngoài cùng.
C. X là nguyên tố d.
D. X có 2 electron phân lớp ngoài cùng.
Câu 178 : Một nguyên tử X có tổng số electron ở các phân lớp s là 6 và tổng số electron lớp ngoài cùng là 6. Cho biết X thuộc về nguyên tố hóa học nào sau đây?
A. Flo (Z = 9)
B. Lưu huỳnh (Z = 16)
C. Clo (Z = 17)
D. Oxi (Z = 8)
Câu 179 : Cation X3+ và anion Y2- đều có cấu hình electron ở phân lớp ngoài cùng là . Kí hiệu của các nguyên tố X, Y lần lượt là (cho biết ).
A. Mg và F.
B. Al và O.
C. Mg và O.
D. Al và F.
Câu 180 : Nguyên tử M có tổng số electron ở phân lớp p là 7 và số nơtron nhiều hơn số proton là 1 hạt. Số khối của nguyên tử M là
A. 25
B. 22
C. 27
D. 28
Câu 181 : Nguyên tử của một nguyên tố X có tổng số hạt cơ bản (p, n, e) là 82, biết số hạt mang điện nhiều hơn số hạt không mang điện là 22. Kí hiệu hóa học của X là
A.
B.
C.
D.
Câu 182 : Cấu hình electron của các nguyên tử có số hiệu Z=3, Z=11, Z=19 có đặc điểm chung là
A. có 4 electron lớp ngoài cùng.
B. có 3 electron ở lớp ngoài cùng.
C. có 2 electron ở lớp ngoài cùng.
D. có 1 electron ở lớp ngoài cùng.
Câu 183 : Ion nào sau đây không có cấu hình electron giống của khí hiếm?
A.
B.
C.
D.
Câu 184 : Trong nguyên tử của nguyên tố X có 29 electron và 36 nơtron. Số khối và số lớp electron của nguyên tố X lần lượt là
A. 65 và 4.
B. 64 và 3.
C. 65 và 3.
D. 64 và 4.
Câu 185 : Cấu hình electron nguyên tử của X là . Phát biểu nào sau đây là sai?
A. Lớp L có 8 electron.
B. Lớp M có 5 electron.
C. Lớp K có 2 electron.
D. Lớp ngoài cùng có 3 electron.
Câu 186 : Một nguyên tử X có tổng số electron ở các phân lớp p là 11. Nguyên tố X thuộc loại
A. nguyên tố f.
B. nguyên tố d.
C. nguyên tố s.
D. nguyên tố p.
Câu 187 : Cho biết sắt có số hiệu nguyên tử là 26. Cấu hình electron của là:
A.
B.
C.
D.
Câu 188 : Trong nguyên tử Y có tổng số proton, nơtron và electron là 26. Nguyên tố Y là
A. F (Z = 9).
B. O (Z = 8).
C. N (Z = 7).
D. C (Z = 6)
Câu 189 : Nguyên tử nào trong hình vẽ dưới đây có số e lớp ngoài cùng là 8
A. 1 và 2
B. Chỉ có 3
C. 3 và 4
D. Chỉ có 2
Câu 190 : Số đơn vị điện tích hạt nhân của clo là 17. Trong nguyên tử clo số electron ở mức năng lượng lớn nhất là:
A. 5
B. 17
C. 2
D. 7
Câu 191 : Cho các phản ứng hóa học sau:
A. (1), (4).
B. (2), (3).
C. (3), (4).
D. (4), (5).
Câu 192 : Trong phản ứng: đóng vai trò
A. là chất oxi hóa.
B. là chất khử.
C. vừa là chất oxi hóa, vừa là chất khử.
D. không là chất oxi hóa, cũng không là chất khử.
Câu 193 : Nhận định nào sau đâu không đúng?
A. Trong các phản ứng hóa học, số oxi hóa của các nguyên tố có thể thay đổi hoặc không thay đổi.
B. Trong các phản ứng phân hủy, số oxi hóa của các nguyên tố luông thay đổi.
C. Trong các phản ứng thế, số oxi hóa của các nguyên tố luôn thay đổi.
D. Trong các phản ứng oxi hóa - khử luôn có sự thay đổi số oxi hóa của một nguyên tố.
Câu 194 : Cho phương trình phản ứng hóa học sau:
A.
B.
C.
D.
Câu 195 : Trong các phản ứng sau, phản ứng nào HCl đóng vai trò là chất oxi hóa?
A.
B.
C.
D.
Câu 196 : Cho phương trình phản ứng: đặc/nóng . X là
A. .
B. .
C. S.
D. .
Câu 197 : Cho sơ đồ phản ứng hóa học sau: Tổng hệ số (nguyên, tối giản) của các chất tham gia và tạo thành trong phản ứng là
A. 18.
B. 20.
C. 16.
D. 14.
Câu 198 : Trong hóa học vô cơ, phản ứng nào sau đây luôn là phản ứng oxi hóa – khử?
A. Phản ứng hóa hợp
B. Phản ứng phân hủy.
C. Phản ứng trung hòa
D. Phản ứng thế.
Câu 199 : Cho sơ đồ phản ứng: . Hệ số cân bằng (nguyên, tối giản) của là
A. 10.
B. 8.
C. 5.
D. 2.
Câu 200 : Lưu huỳnh tác dụng với axit sunfuric đặc nóng theo sơ đồ sau:
A. 1:2.
B. 1:3.
C. 3:1.
D. 2:1.
Câu 201 : Trong các ion (phân tử) cho dưới đây, ion (phân tử) có tính oxi hóa trong các phản ứng oxi hóa – khử là
A. Mg.
B. .
C. .
D. .
Câu 202 : Cho sơ đồ phản ứng:
A. 6 và 3.
B. 3 và 6.
C. 6 và 6.
D. 3 và 3.
Câu 203 : Trong phản ứng:, 1 mol ion đã
A. nhường 1 mol electron.
B. nhận 1 mol electron.
C. nhận 2mol electron.
D. nhường 2mol electron.
Câu 204 :
Cho Al tác dụng với dung dịch theo sơ đồ sau:
A. 8,96.
B. 2,24.
C. 1,12.
D. 3,36.
Câu 205 : Cho Cu tác dụng với dung dịch theo sơ đồ sau:
A. 400.
B. 200.
C. 800.
D. 100.
Câu 206 : Lưu huỳnh tác dụng với dung dịch kiềm đặc, nóng theo sơ đồ sau:
A. 2:1.
B. 1:2.
C. 1:3.
D. 2:3.
Câu 207 : Cho sơ đồ phản ứng:
A. 3 và 5.
B. 5 và 2.
C. 2 và 5.
D. 3 và 2.
Câu 208 : Cho sơ đồ phản ứng sau:
A. 8 : 1.
B. 1 : 9.
C. 1 : 8.
D. 9 : 1.
Câu 209 : Trong các phản ứng sau, ở phản ứng nào đóng vai trò chất oxi hóa?
A.
B.
C.
B. .
Câu 210 : Phản ứng nào sau đây không phải là phản ứng oxi hóa – khử?
A.
B.
C.
D.
Câu 211 : Cho sơ đồ phản ứng sau:
A. x = 1.
B. x = 2.
C. x = 1 hoặc 2.
D. x = 3.
Câu 212 : Nguyên tử clo chuyển thành ion clorua bằng cách
A. nhận 1 electron.
B. nhường 1 electron.
C. nhận 1 proton.
D. nhường 1 proton.
Câu 213 : Nhận định nào sau đây không đúng?
A. Phản ứng thế trong hóa học vô cơ đều là phản ứng oxi hóa – khử.
B. Các phản ứng trao đổi có thể là phản ứng oxi hóa – khử, có thể không là phản ứng oxi hóa khử.
C. Các phản ứng hóa hợp có thể là phản ứng oxi hóa – khử, có thể không là phản ứng oxi hóa khử.
D. Các phản ứng trao đổi đều không phải là phản ứng oxi hóa khử.
Câu 214 : Số mol electron cần dùng để khử 0,25 mol thành Fe là
A. 0,25 mol.
B. 0,5 mol.
C. 1,25 mol.
D. 1,5 mol.
Câu 215 : Hòa tan 19,2 gam kim loại R trong đặc, dư thu được 6,72 lít khí (sản phẩm khử duy nhất ở đktc). Kim loại R là
A. Cu.
B. Mg.
C. Ba.
D. Fe.
Câu 216 : Cho các phương trình hóa học sau:
A. 1.
B. 2.
C. 3.
D. 4.
Câu 217 : Cho các phản ứng:
A. 5.
B. 2.
C. 3.
D. 4.
Câu 218 : Hòa tan 0,1 mol Al và 0,2 mol Cu trong đặc, nóng, dư thu được V lít khí (sản phẩm khử duy nhất ở đktc). Giá trị của V là
A. 3,36.
B. 4,48.
C. 7,84.
D. 5,6.
Câu 219 : Cho hỗn hợp X gồm 0,04 mol Al và 0,06 mol Mg tan hoàn toàn trong đặc nóng thu được 0,12 mol sản phẩm Z duy nhất do sự khử của . Z là
A. .
B. S.
C. .
D. .
Câu 220 : Trong hóa học vô cơ, phản ứng nào sau đây luôn là phản ứng oxi hóa – khử?
A. Phản ứng hóa hợp
B. Phản ứng phân hủy.
C. Phản ứng trung hòa
D. Phản ứng thế.
Câu 221 : Các electron chuyển động trong nguyên tử theo quỹ đạo
A. hình tròn.
B. hình elip.
C. không xác định.
D. hình vuông.
Câu 222 : Phân lớp 3d có số electron tối đa là
A. 6
B. 8
C. 10
D. 14
Câu 223 : Nguyên tử có số proton, electron và nơtron lần lượt là
A. 19, 20, 39.
B. 20, 19, 39.
C. 19, 20, 19.
D. 19, 19, 20.
Câu 224 : Nguyên tử nguyên tố R có 3 lớp electron và lớp ngoài cùng có 7 electron. Số proton của R là
A. 15
B. 17
C. 19
D. 21
Câu 225 : Các hạt cấu tạo nên hầu hết các nguyên tử là
A. proton, nơtron, electron.
B. proton, nơtron.
C. proton và electron.
D. nơtron và electron.
Câu 226 : Nguyên tử R có cấu hình electron là: . Nguyên tố R là
A. kim loại.
B. phi kim.
C. khí hiếm.
D. á kim.
Câu 227 : Trong tự nhiên clo có hai đồng vị: chiếm 75%, chiếm 25% về số nguyên tử. Nguyên tử khối trung bình của clo là
A. 35,5
B. 35,0
C. 37,0
D. 36,5
Câu 228 : Magie có cấu hình electron: . Kết luận nào sau đây đúng?
A. Magie là nguyên tố s.
B. Magie là nguyên tố p.
C. Magie là nguyên tố d.
D. Magie là nguyên tố f.
Câu 229 : Tổng số hạt trong nguyên tử của một nguyên tố X là 46, trong đó số hạt mang điện tích nhiều hơn số hạt không mang điện tích là 14 hạt. Vị trí của nguyên tố X là
A. chu kì 3, nhòm VA.
B. chu kì 5, nhóm VA.
C. chu kì 5, nhóm IIIA.
D. chu kì 3, nhóm VIA.
Câu 230 : Cấu hình electron của anion là . Cấu hình electron của nguyên tử X là
A. .
B. .
C. .
D. .
Câu 231 : Phản ứng nào sau đây không phải là phản ứng oxi hóa khử?
A.
B.
C.
D.
Câu 232 : Những nguyên tử nào sau đây là đồng vị của nhau?
A.
B.
C.
D.
Câu 233 : Phát biểu nào sau đây là không đúng?
A. Lớp electron M có năng lượng cao hơn lớp L.
B. Trong nguyên tử, các electron chuyển động theo quỹ đạo trong hoặc bầu dục.
C. Các phi kim thường có từ 5 đến 7 electron lớp ngoài cùng nguyên tử.
D. Các kim loại thường có từ 1 đến 3 electron lớp ngoài cùng trong nguyên tử.
Câu 234 : Kí hiệu phân lớp nào sau đây không đúng?
A. 6s.
B. 1p.
C. 7p.
D. 1s.
Câu 235 : Phát biểu nào sau đây là không đúng?
A. Theo chiều tăng dần của điện tích hạt nhân, trong một chu kì tính kim loại giảm; trong một nhóm A, tính phi kim giảm.
B. Theo chiều tăng dần của điện tích hạt nhân, trong một chu kì, tính bazơ của các oxit và hiđroxit tăng dần, đồng thời tính axit của chúng giảm dần.
C. Trong một chu kì, tính kim loại tăng dần theo chiều tăng của bán kính.
D. Trong một nhóm A, tính phi kim tăng dần theo chiều tăng của độ âm điện.
Câu 236 : Trong phản ứng:
A. .
B. .
C. .
D. .
Câu 237 : Thành phần của hạt nhân nguyên tử gồm
A. proton, nơtron.
B. electron, proton, nơtron.
C. electron, nơtron.
D. electron, proton.
Câu 238 : Cho sơ đồ phản ứng:
A. 28 : 3.
B. 1 : 3.
C. 3 : 1.
D. 3: 28.
Câu 239 : Công thức cấu tạo của phân tử HCl là
A.
B.
C.
D.
Câu 240 : Phần trăm khối lượng của nguyên tố R trong hợp chất khí với hiđro (R có số oxi hóa thấp nhất) và trong oxit cao nhất tương ứng là a% và b%, với a : b = 11 : 4. Phát biểu nào sau đây là đúng?
A. Phân tử oxit cao nhất của R không có cực
B. Oxit cao nhất của R ở điều kiện thường là chất rắn
C. Trong bảng tuần hoàn các nguyên tố hóa học, R thuộc chu kì 3
D. Nguyên tử R (ở trạng thái cơ bản) có 6 electron s
Lời giải có ở chi tiết câu hỏi nhé! (click chuột vào câu hỏi).
Copyright © 2021 HOCTAP247
