Silicon được sử dụng trong nhiều ngành công nghiệp: gốm, men sứ, thủy tinh, luyện thép, vật liệu bán dẫn, … Hãy biểu diễn cấu hình electron của nguyên tử silicon (Z = 14) theo ô or...
Câu hỏi :
Silicon được sử dụng trong nhiều ngành công nghiệp: gốm, men sứ, thủy tinh, luyện thép, vật liệu bán dẫn, … Hãy biểu diễn cấu hình electron của nguyên tử silicon (Z = 14) theo ô orbital, chỉ rõ việc áp dụng các nguyên lí vững bền, nguyên lí Pauli và quy tắc Hund.
Silicon được sử dụng trong nhiều ngành công nghiệp: gốm, men sứ, thủy tinh, luyện thép, vật liệu bán dẫn, … Hãy biểu diễn cấu hình electron của nguyên tử silicon (Z = 14) theo ô orbital, chỉ rõ việc áp dụng các nguyên lí vững bền, nguyên lí Pauli và quy tắc Hund.
* Đáp án
* Hướng dẫn giải
Ta có: Z = 14 ⇒ Nguyên tử silicon có 14 electron.
- Viết thứ tự các lớp và phân lớp electron theo chiều tăng của năng lượng:
1s 2s 2p 3s 3p 4s …
- Điền các electron vào các phân lớp electron theo nguyên lí vững bền:
1s22s22p63s23p2.
⇒ Cấu hình electron của nguyên tử silicon có Z = 14: 1s22s22p63s23p2, được biểu diễn theo ô orbital là:
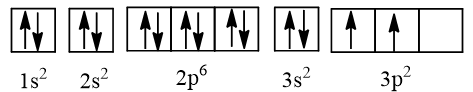
Giải thích:
+ Theo nguyên lí Pauli: Các phân lớp 1s, 2s, 2p, 3s đều chứa tối đa các electron nên trong mỗi AO có 2 electron (kí hiệu ↑, ↓) có chiều quay ngược nhau được viết là ↑↓.
+ Theo quy tắc Hund: Phân lớp 3p chỉ có 2 electron nên các electron phải phân bố sao cho số electron độc thân là tối đa và các electron này có chiều tự quay giống nhau (↑).
Câu hỏi trên thuộc đề trắc nghiệm dưới đây !
Bài tập Cấu trúc lớp vỏ electron nguyên tử có đáp án !!
Copyright © 2021 HOCTAP247
