Vận dụng quy tắc octet để giải thích sự hình thành liên kết trong các phân tử F2, CCl4¬ và NF3.
Câu hỏi :
Vận dụng quy tắc octet để giải thích sự hình thành liên kết trong các phân tử F2, CCl4 và NF3.
Vận dụng quy tắc octet để giải thích sự hình thành liên kết trong các phân tử F2, CCl4 và NF3.
* Đáp án
* Hướng dẫn giải
- Hình thành liên kết trong phân tử F2
Khi hình thành liên kết hoá học trong phân tử F2, nguyên tử fluorine có 7 electron hoá trị, mỗi nguyên tử fluorine cần thêm 1 electron để đạt cấu hình electron bão hoà theo quy tắc octet nên mỗi nguyên tử fluorine góp chung 1 electron.
Phân tử F2 được biểu diễn như sau:
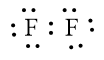
Xung quanh mỗi nguyên tử fluorine đều có 8 electron.
- Hình thành liên kết trong phân tử CCl4
Khi hình thành liên kết hoá học trong phân tử CCl4, nguyên tử chlorine có 7 electron hoá trị, mỗi nguyên tử chlorine cần thêm 1 electron để đạt cấu hình electron bão hoà, nguyên tử carbon có 4 electron hóa trị nên nguyên tử carbon sẽ góp chung với mỗi nguyên tử chlorine 1 electron.
Phân tử CCl4 được biểu diễn như sau:
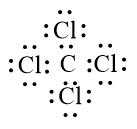
Khi hình thành liên kết hoá học trong phân tử NF3, nguyên tử fluorine có 7 electron hoá trị, mỗi nguyên tử fluorine cần thêm 1 electron để đạt cấu hình electron bão hoà, nguyên tử nitrogen có 5 electron hóa trị nên nguyên tử nitrogen sẽ góp chung với mỗi nguyên tử fluorine 1 electron.
Phân tử NF3 được biểu diễn như sau:
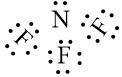
Câu hỏi trên thuộc đề trắc nghiệm dưới đây !
Bài tập Quy tắc octet có đáp án !!
Copyright © 2021 HOCTAP247
