Xét quá trình đốt cháy khí propane C3H8(g): C3H8(g) + 5O2(g)
Câu hỏi :
Xét quá trình đốt cháy khí propane C3H8(g):
C3H8(g) + 5O2(g) 3CO2(g) + 4H2O(g)
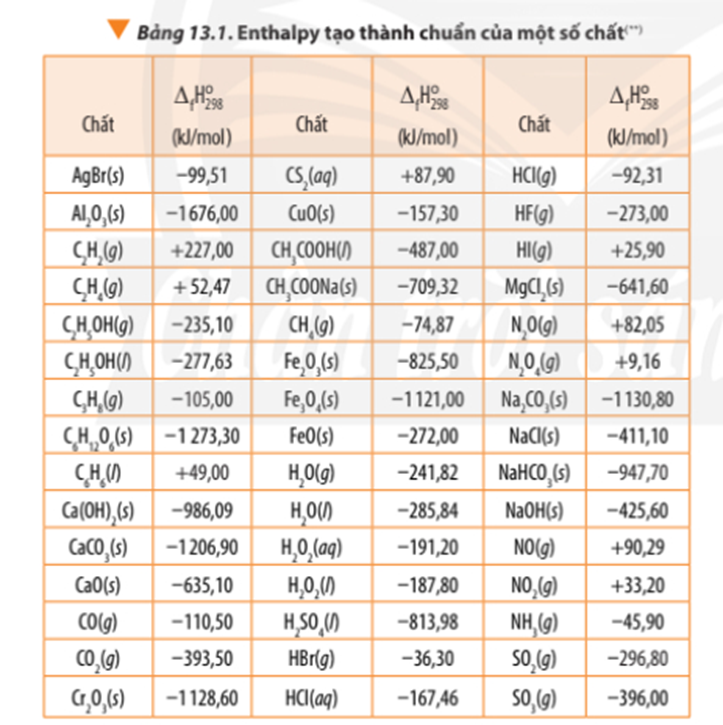
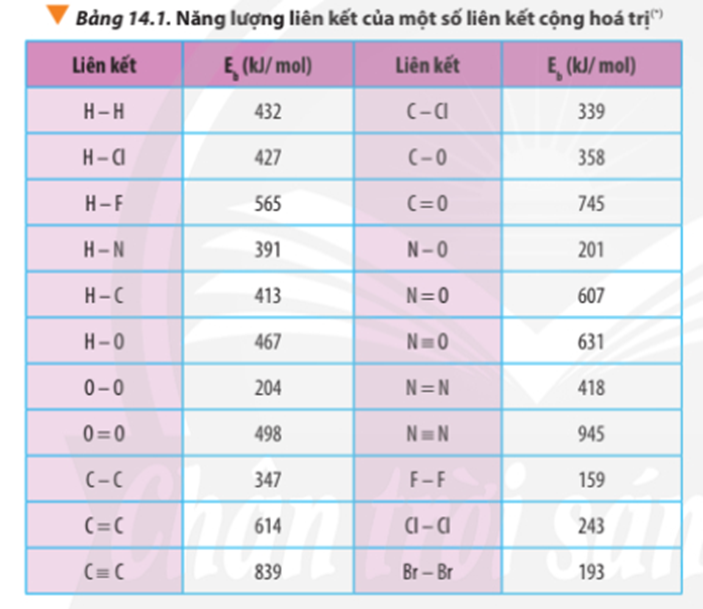
Tính biến thiên enthalpy chuẩn của phản ứng dựa vào nhiệt tạo thành của hợp chất (Bảng 13.1) và dựa vào năng lượng liên kết (Bảng 14.1). So sánh hai giá trị đó và rút ra kết luận.
Xét quá trình đốt cháy khí propane C3H8(g):
C3H8(g) + 5O2(g) 3CO2(g) + 4H2O(g)
Tính biến thiên enthalpy chuẩn của phản ứng dựa vào nhiệt tạo thành của hợp chất (Bảng 13.1) và dựa vào năng lượng liên kết (Bảng 14.1). So sánh hai giá trị đó và rút ra kết luận.


* Đáp án
* Hướng dẫn giải
C3H8(g) + 5O2(g) 3CO2(g) + 4H2O(g)
Tính theo nhiệt tạo thành của hợp chất:
∆ r = 3.∆ f(CO2) + 4. ∆ f(H2O) - ∆ f(C3H8) – 5.∆ f(O2)
∆ r = 3.(-393,50) + 4.(-241,82) – (-105,00) - 5.0
∆ r = -2042,78 kJ
Tính theo năng lượng liên kết:
∆ r = Eb(C3H8) + 5.Eb(O2) – 3Eb(CO2) – 4Eb(H2O)
∆ = 2.Eb(C-C) + 8.Eb(C-H) + 5.Eb(O=O) -3.2.Eb(C=O) - 4.2.Eb(O-H)
∆ r = 2.347 + 8.413 + 5.498 – 3.2.745 – 4.2.467
∆ r = -1718 kJ
Hai giá trị tính được gần bằng nhau.
Câu hỏi trên thuộc đề trắc nghiệm dưới đây !
Bài tập Tính biến thiên enthalpy của phản ứng hóa học có đáp án !!
Copyright © 2021 HOCTAP247
