Trình bày sự tạo thành liên kết hóa học trong các phân tử sau dựa vào sự
Câu hỏi :
Trình bày sự tạo thành liên kết hóa học trong các phân tử sau dựa vào sự lai hóa của các nguyên tử trung tâm:
a) C2H2 b) C2H4 c) NH3
Trình bày sự tạo thành liên kết hóa học trong các phân tử sau dựa vào sự lai hóa của các nguyên tử trung tâm:
a) C2H2 b) C2H4 c) NH3
* Đáp án
* Hướng dẫn giải
a) Công thức Lewis của C2H2 là:
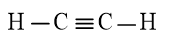
Cấu hình electron của nguyên tử C là: 1s22s22p2
1 AO 2s tổ hợp với 1 AO 2p, tạo 2 AO lai hóa sp
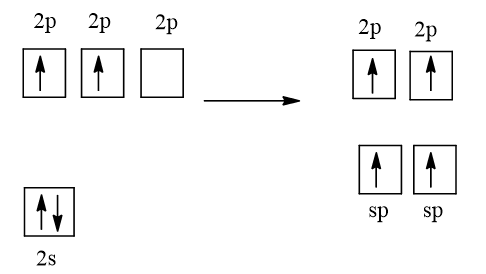
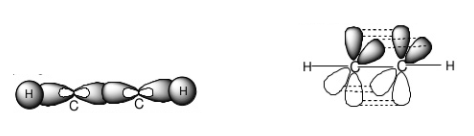
Mỗi nguyên tử C ở trạng thái lai hóa sp. Mỗi nguyên tử C dùng 1 AO lai hóa sp để xen phủ với nhau tạo ra liên kết σC-C. Mỗi nguyên tử C dùng AO lai hóa sp còn lại để xen phủ với AO 1s của một nguyên tử H tạo ra liên kết σC-H. Mỗi nguyên tử C còn lại 2 AO 2p song song từng đôi một. Chúng xen phủ bên với nhau tạo ra 2 liên kết πC-C. Như vậy trong phân tử C2H2 có 3 liên kết σ và 2 liên kết π.
b) Công thức Lewis của C2H4 là:
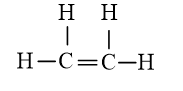
Cấu hình electron của nguyên tử C là: 1s22s22p2
1 AO 2s tổ hợp với 2 AO 2p tạo 3 AO lai hóa sp2.
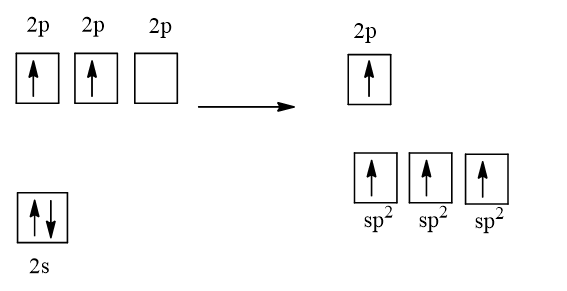
Trong phân tử C2H4 mỗi nguyên tử C có sự lai hóa sp2. Mỗi nguyên tử C dùng 1 AO lai hóa để xen phủ với nhau tạo ra liên kết σC-C. Mỗi nguyên tử C dùng AO lai hóa còn lại để xen phủ với AO 1s của một nguyên tử H tạo ra liên kết σC-H. Mỗi nguyên tử C còn 1 AO p không tham gia lai hóa sẽ xen phủ bên với nhau tạo liên kết πC-C. Như vậy trong phân tử C2H4 có 5 liên kết σ và 1 liên kết π.
c) Công thức Lewis của NH3 là:
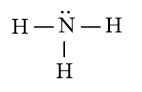
⇒ Công thức VSEPR của NH3 là: AX3E1
Từ công thức VSEPR dự đoán được trạng thái lai hóa của nguyên tử N trong phân tử NH3 là sp3.
Cấu hình electron của N là: 1s22s22p3
1 AO 2s tổ hợp với 3 AO 2p tạo 4 AO lai hóa sp3
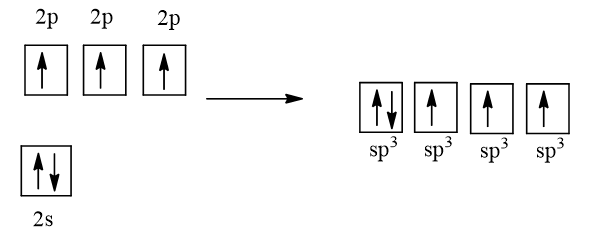
Ba AO lai hóa sp3 (chứa electron độc thân) của nguyên tử N xen phủ với AO 1s của 3 nguyên tử H, tạo va liên kết σ, hướng về ba đỉnh của hình tứ diện. Nguyên tử N còn 1 AO lai hóa sp3 chứa một cặp electron chưa liên kết nằm hướng về đỉnh còn lại của tứ diện. Tuy nhiên cặp electron chưa liên kết này đẩy mạnh hơn nên làm góc liên kết giảm, nên nhỏ hơn 109,5o
Câu hỏi trên thuộc đề trắc nghiệm dưới đây !
Chuyên đề Hóa 10 Bài 1: Liên kết hóa học có đáp án !!
Copyright © 2021 HOCTAP247
