Trang chủ
Đề thi & kiểm tra
Lớp 10
Hóa học
Chuyên đề Hóa 10 Bài 4: Entropy và biến thiên năng lượng tự do Gibbs có đáp án !!
Dựa vào số liệu Bảng 4.1, hãy tính biến thiên...
Dựa vào số liệu Bảng 4.1, hãy tính biến thiên entropy chuẩn của các phản
Câu hỏi :
Dựa vào số liệu Bảng 4.1, hãy tính biến thiên entropy chuẩn của các phản ứng sau:
a) SO3(g) → SO2(g) + O2(g)
và so sánh giá trị của phản ứng này với phản ứng ở ví dụ 1. Giải thích.
b) C(graphite, s) + O2(g) → CO2(g)
Giải thích tại sao giá trị này lại lớn hơn 0 không đáng kể.
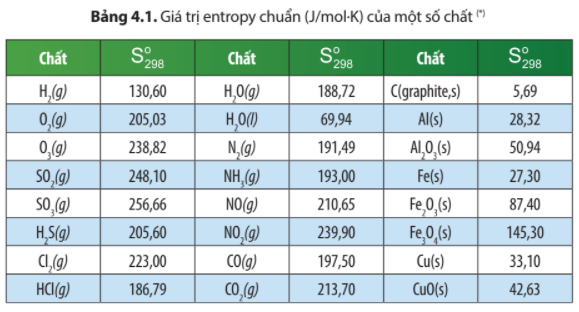
Dựa vào số liệu Bảng 4.1, hãy tính biến thiên entropy chuẩn của các phản ứng sau:
a) SO3(g) → SO2(g) + O2(g)
và so sánh giá trị của phản ứng này với phản ứng ở ví dụ 1. Giải thích.
b) C(graphite, s) + O2(g) → CO2(g)
Giải thích tại sao giá trị này lại lớn hơn 0 không đáng kể.

* Đáp án
* Hướng dẫn giải
=
= × (O2, g) + (SO2, g) - (SO3, g)
= × 205,03 + 248,10 – 256,66 = 93,955 J/K > 0
⇒ Phản ứng phân hủy SO3 làm tăng độ mất trật tự của hệ.
Ở ví dụ 1, phản ứng tổng hợp SO3 có = -93,95 J/K < 0
⇒ Phản ứng làm giảm độ mất trật tự của hệ.
Câu hỏi trên thuộc đề trắc nghiệm dưới đây !
Chuyên đề Hóa 10 Bài 4: Entropy và biến thiên năng lượng tự do Gibbs có đáp án !!
Số câu hỏi: 10
Copyright © 2021 HOCTAP247
