Dựa vào dự liệu Bảng 7.1 và 7.2, em hãy tính biến thiên enthalpy
Câu hỏi :
Dựa vào dự liệu Bảng 7.1 và 7.2, em hãy tính biến thiên enthalpy của phản ứng đốt cháy 1 mol ethanol và 1 mol khí gas.
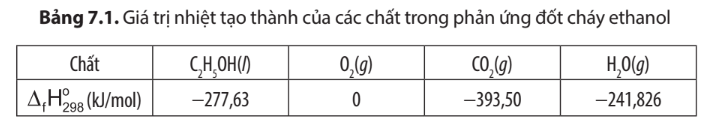
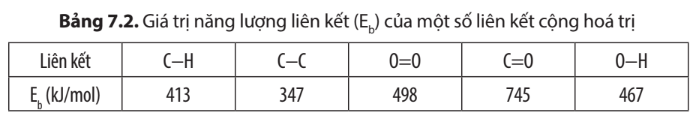
Dựa vào dự liệu Bảng 7.1 và 7.2, em hãy tính biến thiên enthalpy của phản ứng đốt cháy 1 mol ethanol và 1 mol khí gas.


* Đáp án
* Hướng dẫn giải
Phản ứng đốt cháy ethanol:
C2H5OH(l) + 3O2(g) 2CO2(g) + 3H2O(g)
= 2. (CO2, g) + 3. (H2O, g) - (C2H5OH, l) – 3. (O2, g)
= 2.(-393,50) + 3.(-241,826) – (-277,63) – 3.0 = -1234,85 kJ
Phản ứng đốt cháy 1 mol propane:
C3H8(g) + 5O2 (g) 3CO2(g) + 4H2O(g)
= Eb(C3H8) + 5.Eb(O2) – 3.Eb(CO2) – 4.Eb(H2O)
= (2.EC-C + 8.EC-H) + 5.EO=O – 3.2.EC=O – 4.2.EO-H
= (2.347 + 8.413) + 5.498 – 3.2.745 – 4.2.467 = -1718 kJ
Phản ứng đốt cháy 1 mol butane:
C4H10(g) + O2(g) 4CO2(g) + 5H2O(g)
= Eb(C4H10) + .Eb(O2) – 4.Eb(CO2) – 5.Eb(H2O)
= (3.EC-C + 10.EC-H) + .EO=O – 4.2.EC=O – 5.2.EO-H
= (3.347 + 10.413) + .498 – 4.2.745 – 5.2.467 = -2222 kJ
Biến thiên enthalpy phản ứng đốt cháy 1 mol khí gas chứa propane (40%) và butane (60%) là:
= (-1718).0,4 + (-2222).0,6 = -2020,4 kJ
Câu hỏi trên thuộc đề trắc nghiệm dưới đây !
Chuyên đề Hóa 10 Bài 7: Hóa học về phản ứng cháy, nổ có đáp án !!
Copyright © 2021 HOCTAP247
