Hợp chất X được sử dụng làm thuốc pháo, ngòi nổ, thuốc đầu diêm, thuốc giúp nhãn ra hoa, … X có khối lượng mol bằng 122,5 g/mol
Câu hỏi :
Hợp chất X được sử dụng làm thuốc pháo, ngòi nổ, thuốc đầu diêm, thuốc giúp nhãn ra hoa, … X có khối lượng mol bằng 122,5 g/mol, chứa ba nguyên tố, trong đó nguyên tố s có 7 electron s, nguyên tố p có 11 electron p và nguyên tố p có 4 electron p. Thành phần phần trăm khối lượng nguyên tố có 4 electron p trong X bằng 39,19%.
a) Xác định công thức phân tử của X.
b) Viết công thức cấu tạo Lewis, chỉ rõ loại liên kết có trong X.
Hợp chất X được sử dụng làm thuốc pháo, ngòi nổ, thuốc đầu diêm, thuốc giúp nhãn ra hoa, … X có khối lượng mol bằng 122,5 g/mol, chứa ba nguyên tố, trong đó nguyên tố s có 7 electron s, nguyên tố p có 11 electron p và nguyên tố p có 4 electron p. Thành phần phần trăm khối lượng nguyên tố có 4 electron p trong X bằng 39,19%.
a) Xác định công thức phân tử của X.
b) Viết công thức cấu tạo Lewis, chỉ rõ loại liên kết có trong X.
* Đáp án
* Hướng dẫn giải
a) Nguyên tố s có 7 electron s là K (1s22s22p63s23p64s1);
Nguyên tố p có 11 electron p là Cl (1s22s22p63s23p5);
Nguyên tố p có 4 electron p là O (1s22s22p4);
Khối lượng O trong X là: 122,5.0,3919 ≈ 48 (amu) ứng với 3 nguyên tử O.
Công thức X có dạng KxClyO3.
Theo bài ra ta có: 39x + 35,5y = 122,5 – 48 = 74,5
⇒ x = y = 1 ⇒ Công thức X: KClO3.
b) Cấu tạo X:
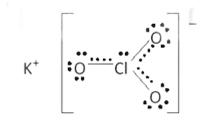
Gồm liên kết K+ và ClO3- là liên kết ion; liên kết đơn Cl-O và liên kết kép Cl=O là các liên kết công hóa trị phân cực
Câu hỏi trên thuộc đề trắc nghiệm dưới đây !
Giải SBT Hóa học Bài 14. Ôn tập chương 3 có đáp án !!
Copyright © 2021 HOCTAP247
