Hoà tan cùng một lượng kim loại R vào dung dịch HNO3 đặc nóng và vào dung dịch
Câu hỏi :
Hoà tan cùng một lượng kim loại R vào dung dịch HNO3 đặc nóng và vào dung dịch H2SO4 loãng thì thể tích NO2 thu được bằng 3 lần thể tích H2 cùng điều kiện, khối lượng muối sunfat bằng 62,81% khối lượng muối nitrat tạo thành. Mặt khác khi nung cùng một lượng kim loại R như trên thì cần thể tích O2 bằng 22,22% thể tích NO2 ở trên cùng điều kiện thu được chất rắn A. Hoà tan 20,88 gam A vào dung dịch HNO3 20% (lấy dư 25% so vói lượng cần thiết) thu được 0,672 lít khí B (dktc) là một oxit của nitơ NxOy. Khối lượng dung dịch HNO3 đã sử dụng là:
A. 66,15 gam
B. 264,6 gam
C. 330,75 gam
D. 266,4 gam
* Đáp án
C
* Hướng dẫn giải
Đáp án C
Áp dụng định luật bảo toàn mol electron, ta có:
Mà
Nên ne nhường(1) =3/2 ne nhường(2)
Do đó số mol electron trao đổi ở hai trường hợp là không giống nhau nên R là kim loại có nhiều hóa trị.
Mà kim loại có hóa trị I, II hoặc III.
Kết hợp với
Ta được R có hóa trị II và III (trong đó R thể hiện hóa trị II khi tác dụng với dung dịch H2SO4 loãng và thể hiện hóa trị III khi tác dụng với dung dịch HNO3 đặc nóng).
Chọn 3 mol R đem hòa tan ban đầu. Khi đó ở các lần thí nghiệm ta thu được 3 mol R(NO3)3 và 3 mol RSO4.
Theo giả thiết ta có:
hay R + 96 = 62,81%(R +186)ÛR = 56ÞR là Fe.
Khi đó, áp dụng định luật bảo toàn moi electron ta có số mol NO2 tạo thành là: n NO2= 3nFe=9
Khi đó lượng oxi đã sử dụng là 9.22,22% = 2
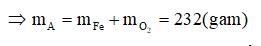
A sẽ chứa một hoặc một số oxit của Fe. Để đơn giản cho quá trình tính toán, coi A là hỗn hợp chứa 3 mol Fe và 4 mol O.
Khi đó trong 20,88 gam A (20,88 = 0,09.232) có 0,27 mol Fe và 0,36 mol O.
nB = 0,03.
Gọi n là số mol electron mà x mol nguyên tử nhận để thu được 1 mol NxOy
Áp dụng định luật bảo toàn mol electron, ta có:
Khi đó:
Câu hỏi trên thuộc đề trắc nghiệm dưới đây !
Bài tập Phản ứng oxi hóa - khử có lời giải chi tiết !!
Copyright © 2021 HOCTAP247
