Trang chủ
Đề thi & kiểm tra
Lớp 10
Hóa học
Trắc nghiệm Hóa học 10 Bài 14. Tính biến thiên enthalpy của phản ứng hóa học có đáp án !!
Cho phương trình nhiệt hóa học sau:2H2 (g) + O2...
Cho phương trình nhiệt hóa học sau:2H2 (g) + O2 (g) ⟶ 2H2O (g) delta r H 0 298 = − 483,64 kJSo sánh đúng là
Câu hỏi :
Cho phương trình nhiệt hóa học sau:
A. 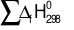 (cđ) >
(cđ) >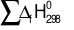 (sp);
(sp);
B. 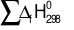 (cđ) =
(cđ) = 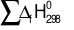 (sp);
(sp);
C. 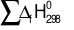 (cđ) <
(cđ) <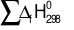 (sp);
(sp);
D. 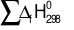 (cđ) ≤
(cđ) ≤ 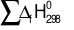 (sp).
(sp).
* Đáp án
* Hướng dẫn giải
Đáp án đúng là: A
Ta có: 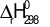 =
= 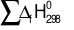 (sp) –
(sp) – 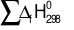 (cđ)
(cđ)
Với 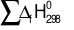 (cđ);
(cđ); 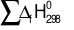 (sp) là tổng enthalpy tạo thành ở điều kiện chuẩn của chất đầu và sản phẩm của phản ứng.
(sp) là tổng enthalpy tạo thành ở điều kiện chuẩn của chất đầu và sản phẩm của phản ứng.
Xét phương trình nhiệt hóa học:
2H2 (g) + O2 (g) ⟶ 2H2O (g) 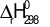 = − 483,64 kJ
= − 483,64 kJ
Ta thấy: 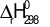 = − 483,64 kJ < 0
= − 483,64 kJ < 0
Nên 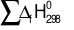 (sp) –
(sp) – 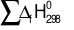 (cđ) < 0
(cđ) < 0
Do đó: 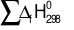 (sp) <
(sp) <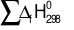 (cđ) hay
(cđ) hay 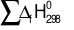 (cđ) >
(cđ) >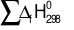 (sp).
(sp).
Câu hỏi trên thuộc đề trắc nghiệm dưới đây !
Trắc nghiệm Hóa học 10 Bài 14. Tính biến thiên enthalpy của phản ứng hóa học có đáp án !!
Số câu hỏi: 15
Copyright © 2021 HOCTAP247
